la mise en culture

LICENCE SCIENCES BIOLOGIQUES
Module Biologie cellulaire II
TP CULTURE CELLULAIRE
1ère Partie : MECANISMES D'ADHESION ET DE MIGRATION
CELLULAIRE
L'embryologie, science d'abord descriptive, s'est rapidement tournée vers la compréhension des
mécanismes permettant le développement des organismes. Chez la plupart des oiseaux, animaux
ovipares, le développement embryonnaire se réalise essentiellement en dehors de l'organisme
maternel. La fourniture des ressources énergétiques et aqueuses mais aussi la protection de l'embryon
sont permis par les annexes embryonnaires : Vitellus, Amnios et Allantoïde.
Durant l'embryogénèse, outre les mécanismes de division cellulaire, des systèmes de reconnaissance,
de migration et de différenciation cellulaires permettent la formation des tissus et organes. De
nombreuses molécules ont été mises en évidence depuis une trentaine d'années :
Molécules de la matrice extracellulaire : collagène, fibronectine, laminine...
Molécules membranaires : cadhérines, intégrines, CAM(s)...
Des mécanismes moléculaires plus ou moins complexes permettent à ces éléments d'établir des
contacts intercellulaires, des migrations et des agrégations nécessaires au développement de
l'embryon.
Les techniques de culture cellulaire permettent, depuis une cinquantaine d'années, de mieux
comprendre les mécanismes biologiques et cellulaires. Que ce soit pour le maintien en survie des
cellules ou pour la multiplication et la croissance cellulaire, les paramètres de culture doivent être
parfaitement établis afin de rendre reproductibles les manipulations. Différents modes de culture
existent, et nous emploierons la culture de cellules adhérentes à un support (boite de culture plastique).
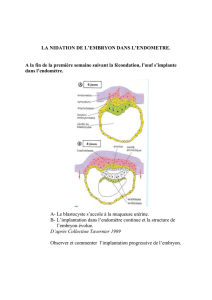
A. L'EMBRYON ET LES ANNEXES EMBRYONNAIRES (1ère séance)
Matériel : paire de ciseaux, pinces, boîte de Pétri.
But : première approche du matériel employé lors de la mise en culture. Approche « de visu » d'un
embryon d'oiseau.
Par 2 ou 3 binômes, observation d’un oeuf de poule dont l'embryon est à environ 7 jours de
développement. Ouvrir délicatement l’œuf à l'aide des ciseaux, coté "gros bout". Observer la
disposition de l'embryon. Faire glisser l'embryon et les liquides de l’œuf, doucement, dans une boîte
de Pétri grand modèle. Observer l'embryon dont l'allure est déjà très avancée au bout d'un tiers de
développement : observer l'allure de la tête, l'ébauche du bec, les ébauches des ailes et des pattes, le
cœur déjà fonctionnel. S'attarder sur la zone cérébrale afin de bien repérer : yeux, hémisphères
cérébraux et les lobes optiques plus volumineux en arrière.
Faire un schéma grossier de l'embryon mettant en évidence vos observations (attention à respecter les
tailles relatives des différents éléments représentés). Sur ce schéma, faire figurer aussi les annexes
embryonnaires reconnaissables à ce stade de développement. Indiquer succinctement sur le compte
rendu les rôles de ces annexes.
B. MISE EN CULTURE DE CELLULES CEREBRALES EMBRYONNAIRES DE POULET
(1ère séance)
Mise en garde : la culture cellulaire n'est pas une manipulation comme les autres, elle nécessite de la
concentration et le respect des règles d'hygiène et de stérilité qui vous seront indiquées au cours du
TP.
Le matériel utilisé ne sera que celui disposé dans les hottes. Ce matériel (le votre ou celui fourni par
l'enseignant) aura été stérilisé auparavant.

Il va s'agir d'étudier les capacités d'adhésion, de migration et d'agrégation des cellules cérébrales de
l'embryon de poulet selon le milieu sur lequel elles sont mises en culture.
Les boîtes de culture (60 x 15 mm) stériles auront reçu l'un des trois revêtements suivants :
Boîtes PL : la veille de la mise en culture, 2.5 ml d'un tampon borate (0.1 M, poids
moléculaire de l'acide borique : 61.8 ; pH 8.4 ajusté avec de la soude 1 M) contenant en plus 0.001 %
de Poly L Lysine (stockage sous forme de poudre) sont déposés au fond des boîtes.
Boîtes BO : idem que précédemment sans la poly L lysine.
Boîtes FB : 1 heure avant la mise en culture, 200 µl d'une solution de fibronectine telle que
l'on dépose 2 µg/cm2 de fibronectine à partir du produit Sigma F1141 (documentation : voir fiches
TP) et d'une solution tamponnée stérile EBSS (Earle balanced salt solution).
PRECHAUFFAGE DU MILIEU
Dès le début de la séance, sous la hotte, les liquides contenant les revêtements des différents types de
boite seront retirés. Puis chaque boite sera lavée une fois avec du milieu DMEM-base (voir
documentation fiche TP), puis recevra 2.5 ml de milieu de culture complet. Les boites sont placées à
37°C dans l'incubateur à CO2.
MISE EN CULTURE
Chaque binôme réalise la manipulation suivante :
ETAPE 1: la dissection (effectuée par un des membres du binôme)
Se nettoyer les mains à l'alcool. Prendre un oeuf de poule dont l'embryon est à 7-8 jours de
développement. Nettoyer l’œuf avec un coton imbibé d'alcool.
Sous la hotte, à l'aide des ciseaux faire une ouverture coté "gros bout" et sortir l'embryon à
l'aide de la grosse paire de pinces. Attention à l'amnios qui tend à retenir l'embryon dans l’œuf. Placer
l'embryon dans une boîte de Pétri contenant un peu de milieu DMEM-base. Couper la tête de
l'embryon et la placer dans une seconde boîte remplie elle aussi d'un peu de milieu DMEM-base.
En tenant la tête avec les pinces, dégager aux pinces fines ou aux ciseaux les hémisphères
cérébraux. Attention à ne pas confondre les lobes optiques placés en arrière des hémisphères et qui
sont plus volumineux à ce stade.
Dans un flacon à bouchon rouge contenant 5 ml de milieu de culture complet, placer les deux
hémisphères cérébraux que l'on aura au préalable débarrassés des méninges les entourant par agitation
dans la boîte de Pétri à l'aide d'une pince.
ETAPE 2: la mise en culture (effectuée par l'autre membre du binôme)
Avant d'entrer les mains sous la hotte, les nettoyer à l'alcool. Le premier travail aura été
d'aider dans ses manipulations son voisin en lui fournissant les instruments et le matériel nécessaire s'il
le souhaite.
Puis, il aura fallu préparer le flacon à bouchon rouge que l'on remplit de 5 ml de milieu de
culture complet. Quand on reçoit les deux hémisphères dans ce flacon, homogénéiser le tissu en le
faisant passer plusieurs fois dans une seringue équipée d'un trocart.
Quand la solution est homogène, ajouter 5 ml de milieu de culture complet (on obtient
approximativement 5.105 cellules/ml). Bien mélanger et déposer avec une pipette stérile neuve 2.5 ml
du mélange dans chaque boîte de Pétri contenant déjà 2.5 ml de milieu complet préchauffé.
Refermer la boîte de Pétri. Indiquer sur chaque boite par une abréviation lisible un repère
permettant l'identification plus tard.
Observer au microscope inversé l'allure des cellules en suspension. Au bout d'une demi--
heure environ, observer de nouveau votre boîte. Noter l'évolution observée.
ETAPE 3: l'entretien des cultures
Vos boîtes verront leur milieu de culture changé le lendemain. Elles seront observées et
photographiées régulièrement (voir organisation avec l'enseignant).
Une semaine plus tard, les photos vous seront montrées et vous observerez par vous même
l'état de vos différentes cultures.

A l'aide des documents techniques fournis dans les fiches à votre disposition dans la salle de TP,
donner le protocole permettant d'obtenir les différentes solutions utilisées* (tampon borate, poly
Lysine, fibronectine). Attention, le gaspillage est l'ennemi des laboratoires, montrez vous économe
dans votre protocole. (* pour 10 boites par revêtement)
En résumant au maximum, indiquez les différentes étapes de la mise en culture que vous aurez
réalisée.
ETAPE 4: l'observation des cultures (2ème séance)
Si possible au cours de la semaine séparant votre mise en culture et l'observation finale, vous pourrez
venir observer vos boites. (Organisation à définir avec l'enseignant).
Au bout d’une semaine lors de la seconde séance de TP, observation et prise de photos sont à réaliser
ainsi que la préparation de votre rapport de compte rendu.
ATTENTION LE COMPTE RENDU EST A RENDRE A LA FIN DE LA TROISIEME SEANCE
DE TP.
Les questions qui se posent sont :
Quelles sont les cellules cérébrales qui ont adhéré et poussé ?
Indiquez l'évolution au cours de la culture de ces cellules selon le revêtement qui leur a été fourni.
Interprétez ces développements
LES FICHES DE TP (1ère et 2ème séance)
A votre disposition au cours des séances, ces fiches rassemblées dans un classeur présentent des
images du développement embryonnaire de l'oiseau vu sous l'aspect descriptif et moléculaire, des
informations sur la culture et des applications expérimentales des recherches effectuées dans ce
domaine. Des indications sur les produits employés sont également fournies vous permettant de plus
facilement rédiger la partie Matériel et Méthodes. Une bibliographie vous est également fournie. A
vous de tirer partie de ces informations pour la rédaction du compte rendu.
2ème Partie : MARQUAGES SUBCELLULAIRES DE CULTURES
PRIMAIRES DE FIBROBLASTES
1ère séance : Culture primaire de fibroblastes de poulet
1) Matériels et milieux utilisés
-Embryons de 8 jours
-Outils de dissection
-Milieu de culture CEF :
DMEM 4,5g/l glucose : 500ml
Sérum poulet : 0,6ml
SVF : 2,5ml
Antibiotiques+antifongiques X10 : 5ml
-Boites de Pétri de 60mm
2) Manipulation
-Préchauffer le milieu CEF
-Laver l'œuf à l'éthanol, l'ouvrir, prélever l'embryon et le placer dans une boite de Pétri contenant 5ml
de milieu
-Enlever la tête, les membres et les viscères à l'aide de pinces, transférer le "corps" dans une boite de
60mm content 5ml de milieu CEF. Le hacher finement. Homogénéiser la suspension en passant la
suspension à travers une aiguille fine (maintes fois). Transférer dans un tube et laisser décanter les
agrégats. Récupérer le surnageant et ensemencer avec 0,5 ml de suspension cellulaire dans une boite
de Pétri. Compléter à 5ml de milieu CEF et placer à l'étuve (37°C, 5%CO2).

2ème séance : Entretien de cultures cellulaires
1) Matériels et milieux utilisés
-Milieu CEF
-Trypsine/EDTA, PBS
-Boites à 4 trous et boites de Pétri de 30mm
-Cellules fibroblastes primaires
2) Manipulation
-Observer les cellules au microscope inversé (les cellules doivent être confluentes)
-Eliminer le milieu et faire un rinçage avec 2ml de PBS
-Ajouter 1,5ml de trypsine/EDTA. Attendre quelques minutes et suivre le décollement au microscope.
Ajouter aussitôt 0,2ml de SVF. Transférer dans un tube. Centrifuger 3min à 1500rpm
-Eliminer le surnageant et re-suspendre le culot dans 3ml de milieu CEF
-Compter les cellules sur lames de Malassez après coloration au bleu trypan (50l cellules +50l bleu)
et déterminer la concentration cellulaire.
-Ensemencer 1,2 103 cellules /lamelle dans 1 ml de milieu CEF et 5. 104 cellules dans 2 ml de milieu
CEF (boite de diamètre 30mm)
3ème séance : Cytologie : Marquages subcellulaires
I-Coloration des organiques cellulaires de façon aspécifique:
-Fixation des cellules :
-Vider le milieu de culture. Ajouter le fixateur (formaldéhyde 10% dans du PBS pH 7,4).
-Coloration :
-Sans rincer, ajouter 1ml de colorant Giemsa puis 4ml d'eau bi-distillée. Bien homogénéiser.
Laisser 10 min puis observer.
II-Marquage de l'ADN par l'acridine orange
1) Matériels et milieux utilisés
-Culture de cellules sur lamelles (24x60)
-Acridine orange. Solution stock à 1% dans H2O (aliquotée et conservée à l'obscurité à 4°C)
-Acide citrique 0,1M
-Na2HPO4-7H2O 0,3M
-Solution colorante : 10 ml solution stock d'acridine orange + 40ml acide citrique 0,1M + 2,5ml de
Na2HPO4-7H2O 0,3M. Le pH final doit être de 2,5 (le cas échéant, ajuster avec de l'acide citrique)
-Solution de fixation : Solution de Carnoy (à préparer extemporanément) 3 volumes de méthanol+1
volume d'acide acétique glacial
-PBS filtré
-PBS/glycérol 50%
2) Manipulation
-Observer les lamelles. Placer votre lamelle dans une boite de diamètre 30mm (attention à leur
fragilité)
-Rincer délicatement les lames dans du PBS FILTRE (2 fois)
-Fixation dans la solution de Carnoy pendant 1 h
-Rincer délicatement les lames dans du PBS FILTRE (2 fois). Sécher
-Placer dans la solution colorante pendant 5 min
-Rincer délicatement les lames dans du PBS FILTRE (3 fois)
-Recouvrir la lame de PBS/glycérol 50%. Placer une lamelle et luter
-Observer au microscope (longueur d'onde d’excitation : 490nm, longueur d’onde d’émission :
530nm)
Le compte rendu de cette deuxième partie sera à rendre 1 semaine après la 3ème séance de TP
1
/
4
100%