METHODES ORGANIQUES

METHODES ORGANIQUES
I – LA DECANTATION
1) Matériel : l’ampoule à décanter
2) Remarques :
Salage des couches aqueuses : lorsque la densité de la phase organique est proche de celle de l’eau, l’addition
d’un sel inorganique, fréquemment du chlorure de sodium, augmente la densité de la phase aqueuse. Cette
opération permet d’obtenir rapidement une meilleure séparation.
De plus, la présence de sel diminue la solubilité des composés organiques dans l’eau, qui passe ainsi dans la
phase organique par effet de relargage.
II – LA RECRISTALLISATION
Les composés solides obtenus par synthèse organique ou extraits de substances naturelles sont souvent
contaminés par de faibles quantités d'impuretés. La technique habituelle de leur purification est la
recristallisation, basée sur leur différence de solubilité à chaud et à froid dans les solvants.
La solubilité d'un solide augmente généralement avec la température ; aussi, lorsqu'il est solubilisé dans un
solvant chaud, sa cristallisation peut être provoquée par le refroidissement de la solution jusqu'à sursaturation. La
recristallisation consiste donc à dissoudre d'abord le solide à purifier dans un solvant ou dans un mélange de
plusieurs solvants chauds, généralement à l'ébullition, puis à refroidir la solution pour provoquer la cristallisation
du solide que l'on isole par filtration. Quant aux impuretés, trois cas peuvent se présenter :
elles sont insolubles dans le solvant chaud : une simple filtration de la solution chaude permet de les
éliminer;
elles sont solubles dans le solvant chaud et le demeurent partiellement dans le solvant froid ; la plus grande
partie reste habituellement dissoute au moment de la cristallisation du produit principal et est éliminée avec
le filtrat ;
elles sont très solubles dans le solvant chaud et peu solubles dans le solvant froid ; la filtration isole un
produit contaminé et, dans ce cas, la recristallisation est peu efficace.
La purification est d'autant plus aisée que le taux initial d'impuretés est plus faible.
Choix du solvant
Les similitudes physico-chimiques du solvant et du produit à purifier constituent le critère le plus général de
sélection du solvant de recristallisation. Entre autres, leur polarité doit souvent être voisine. Le choix s'effectue
par des tests de solubilité ou à l'aide des tables de constantes en tenant compte des exigences suivantes :
le solvant ne doit pas réagir chimiquement avec le solide à purifier;
la solubilité du produit doit être élevée dans le solvant chaud et faible dans le solvant froid ; une solubilité

cinq fois plus grande dans le solvant chaud est généralement acceptable ;
les impuretés organiques doivent être solubles dans le solvant froid ; elles restent alors en solution au
moment de la cristallisation` ;
la température d'ébullition du solvant devrait être inférieure au point de fusion du solide ; autrement, une
phase huileuse risque de se former;
le solvant devrait être peu toxique et peu inflammable, mais la majorité des liquides organiques possède
rarement ces deux caractéristiques à la fois.
Le tableau ci-dessus donne la liste des solvants usuels, leur point d'ébullition et une évaluation de leur
inflammabilité et de leur toxicité. Ils sont classés, de l'eau à l'hexane, selon l'ordre approximatif décroissant de
polarité.
Éther diéthylique : peu recommandé à cause de sa très grande inflammabilité et à cause du faible écart entre la
température ambiante et son point d'ébullition.
Benzène: à éviter du fait de sa toxicité dont son caractère cancérigène ; il doit être remplacé par le toluène ou le
cyclohexane, lorsque c'est possible.
Solvants chlorés: à manipuler sous la hotte.
Lorsque les valeurs des solubilités ne sont pas connues, le choix du solvant se fait à l'aide du test suivant :
mettre environ 1,0 g d'échantillon dans un tube à essai ou dans un petit erlenmeyer et ajouter 3 cm3 de
solvant ; si le solide se dissout facilement à la température ambiante ou par un léger chauffage, le solvant
n'est pas approprié ;
chauffer le mélange près du point d'ébullition en agitant et poursuivre l'addition de solvant par fractions
d'environ 1 cm3 ; observer l'évolution de la dissolution;
III – SECHAGE
Les desséchants chimiques sont des solides inorganiques qui fixent l’eau lorsqu'ils sont ajoutés au liquide
humide. Ils sont choisis parmi des sels anhydres susceptibles de s'hydrater, certains oxydes et certains
hydroxydes.
Ils doivent agir avec rapidité et leur capacité d'absorption de l'eau doit être excellente. Mais ils doivent aussi
satisfaire aux exigences suivantes
- ne pas se dissoudre dans le liquide à sécher;
- ne pas provoquer, directement ou indirectement, de réactions chimiques
avec le liquide à sécher;
- ne pas donner lieu à un équilibre chimique avec l'eau, dans lequel la proportion d'eau résiduelle est trop élevée.
Les principaux agents desséchants, avec leurs qualités, leurs compatibilités et leurs incompatibilités, sont
présentés dans le tableau ci-dessous
Pour effectuer le séchage, on ajoute au liquide une petite quantité de desséchant et on agite ; si les cristaux ont
tendance à s'agglomérer et à coller aux parois, il faut en ajouter de nouveau. Le séchage est effectif lorsque la

fraction de desséchant nouvellement introduite, après un séjour de quelques minutes, se déplace encore librement
dans le liquide. L'excès ne doit pas être trop grand, afin de limiter les pertes de liquide organique par absorption.
Lorsque la quantité d'eau est importante, il est parfois nécessaire, après filtration du mélange, de répéter une ou
plusieurs fois l'opération précédente. On peut, dans ce cas, faire varier la nature du desséchant en commençant
avec un composé ayant une grande capacité d'absorption et en terminant avec un composé ne laissant pas d'eau
résiduelle. Il est possible qu'au début, il y ait apparition d'une couche aqueuse, due à la dissolution du desséchant
et au relargage de la couche organique ; il faut alors séparer les deux couches et sécher de nouveau.
Après séchage, le desséchant est le plus souvent éliminé par filtration, soit sur un filtre plissé, soit sur un büchner
sous faible dépression, la fiole à vide étant refroidie avec un bain glacé. Même lorsque le liquide est ensuite
distillé, la filtration est généralement nécessaire, car la plupart des desséchants libèrent l'eau absorbée lorsqu'ils
sont chauffés. Quelques rares desséchants, dont CaO, échappent à cette règle et autorisent la distillation du
mélange sans filtration préalable.
L'emploi de desséchants chimiques a l'avantage d'être applicable au laboratoire dans presque tous les cas. Cette
méthode a cependant l'inconvénient d'entraîner une perte de produit organique par retenue dans le filtre et dans la
masse cristalline du desséchant.

Bibliographie :
Chimie organique expérimentale ( 2e édition)
M.Chavanne , A.Jullien, G.J. Beaudoin, E.Flamand
Edition : Belin

CHIMIE . ENSEIGNEMENT DE SPECIALITE
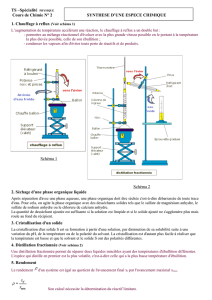
B- Créer et reproduire des espèces chimiques ( 2 séances)
Objectifs :
Réinvestissement sur l’opposition chimie et nature . Nécessité économique d’élaborer une
chimie de synthèse.
Techniques ou procédés de laboratoire : chauffage à reflux , distillation, lavage d’une phase
organique, séchage d’une phase organique liquide, extraction liquide-liquide, séchage d’un
solide, cristallisation, recristallisation
Preparation du paracetamol.
Le paracétamol est un composé qui, d’un point de vue thérapeutique, possède des propriétés
voisines de celles de l’aspirine.
Il sera préparé par acétylation du para-aminophénol.
Pour les enseignants :
L’acétylation consiste à remplacer l’atome d’hydrogène mobile d’une fonction hydroxylée, alcool
ou phénol, ou d’une fonction amine par le groupement acétyle :
Le schéma général d’une réaction d’acétylation peut être donné par :
Dans lesquelles R peut être aliphatique, alicylique ou aromatique.Au cours de ces réactions, le
doublet électronique de la fonction hydroxyle ou amine agit comme réactif nucléophile attaquant le
carbone du groupement carbonyle ; le mécanisme simplifié de l’acétylation du paraaminophénol
est :
L’intérêt de la réaction d’acétylation réside dans le fait qu’elle permet, d’une part, de préparer des
esters acétiques de phénols non accessibles par réaction directe entre l’acide et le phénol et, d’autre
part, de protéger une fonction alcool ou amine. De plus, avec les amines aromatiques, elle conduit à
des composés dont la réactivité du cycle est diminuée, ce qui permet la réalisation sélective de
substitutions électrophiles sur le noyau, souvent suivies de la régénération de la fonction amine par
hydrolyse.
CH3c
O
RNH+ CH3COCCH3
O O
RNC
O
CH3+CH3COOH
CH3C
O
CH3C
O
O+RNH
H
CH3C
O
O
COCH3
N
H
H
R
+
-
CH3C
O
COCH3
N R
OH
CH3CO
N
H
R
+CH3COOH
1
/
5
100%