le dioxygene et ses oxydes

Sarah Garçon TP de Chimie Inorganique Magistère PCM
Brahim Zardoua
- 1 -
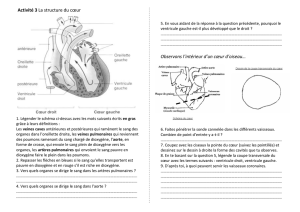
TP IN1 : LE DIOXYGENE ET SES OXYDES
I – Préparation
1. Méthode de préparation de O2(g) au laboratoire
Schéma du dispositif
Observations
Lorsqu’on verse goûte à goûte l’eau oxygénée, de la fumée blanche se
produit dans le ballon et des bulles remontent dans l’éprouvette : il y
a formation d’un gaz.
1Quand on approche un brin de paille incandescent de l’éprouvette, il
s’enflamme. Cela prouve donc la présence de dioxygène.
Interprétations
D’après la règle du gamma, on peut prévoir la réaction
d’oxydoréduction qui a lieu :
H2O2 = O2 + 2e- + 2H+
2HClO + 4H+ + 4e- = Cl2 + 2H2O
=> 2H2O2 + 2HClO = Cl2 + 2H2O + O2
ainsi que
H2O2 + 2H+ + 2e- = 2H2O
2Cl- = Cl2 + 2e-
=> H2O2 + 2Cl- + 2H+ = 2H2O + Cl2
L’eau de javel contient des ions ClO- et Cl- en milieu basique.

Sarah Garçon TP de Chimie Inorganique Magistère PCM
Brahim Zardoua
- 2 -
2. Electrolyse de l’eau
Schéma du dispositif
Observations
Lorsque la tension atteint 3.8V on observe des petite bulles remonter dans les tubes à
essaies.
Puis on a réglé la tension à 5V pendant 5 minutes afin de former les gaz plus
rapidement. On remarque qu’à gauche plus de gaz s’est formé qu’à droite. On a
VH2=10,8 mL et VO2=5,5 mL pour une intensité constante de 300mA.
On met en évidence les gaz recueillis :
Afin de tester la présence de H2, on approche une bûchette enflammée du tube à
essai. Il se produit un bruit caractéristique appelé « jappement ».
Afin de tester la présence de O2, on approche une bûchette incandescente du tube à
essai. La bûchette s’enflamme.
Interprétations
Cette méthode est efficace et nous permet d’obtenir des produits purs, mais elle n'est
pas la moins chère pour produire du dioxygène et du dihydrogène industriellement.
De plus, elle nécessite de grandes quantités d’électricité.
L'électrolyse peut être utilisée pour décomposer l'eau en dihydrogène et en
dioxygène.
Réactions :
Oxydation à l'anode (1) : 2H2O(l) = O2(g) + 4e - + 4H+(aq) E°= -1.23V
Réduction à la cathode (2) : 2H+(aq) + 2e - = H2(g) E°= 0.00V
Globalement, nous avons : 2H2O(l) = 2H2(g) + O2(g) E°= -1.23V
Les gaz formés sont donc du dihydrogène et du dioxygène puisqu'il n'y a que ces gaz
susceptibles de se former.
Tableau d’avancement du système :
2H2O(l) = O2(g) + 2 H2(g)
Nb e-
échangés
Etat initial
excès
0
0
0
Etat interm.
excès
x
2x
4x
Etat final
excès
Xmax
2xmax
4xmax

Sarah Garçon TP de Chimie Inorganique Magistère PCM
Brahim Zardoua
- 3 -
Il faut appliquer une tension minimale pour observer l’electrolyse, sinon elle ne se fait
pas. Une autre réaction est succeptible de se produire à l’anode :
2 SO42-(aq) = S2O82-(aq) + 2e – E°= -2.01V
La tension minimale est donc V= 2.01+1.23 = 3.24V
Expérimentalement, l’apparition des premières bulles à eu lieu à 3.8V ce qui parait
correcte.
Calculons les volumes théoriques de gaz formés correspondant à l’intensité
appliquée : I=300mA.
D’après le tableau : nO2 = n H2 / 2 or Vm = V gaz / n gaz
Donc Vm = V O2 /n O2 = VH2 /nH2
2V O2 /n H2 = VH2 /nH2
2V O2 = VH2
Il y a donc deux fois plus de dihydrogène formé que de dioxygène, ce qui est
parfaitement concordant avec les observations.
Quantité de matière n(e) d'électrons échangés lors de la transformation :
Q = n(e).F donc n (e) = Q / F = I.Δt/ F = 0,3. 5.60 / 96500 = 9,33.10-4 mol
et n (e) = 4.x d'après le tableau d'avancement => x = n (e) /4 = 2,33.10-4 mol
nH2 = 2.x
VH2= nH2.MH2 / H2
= 2. 2,33.10-4 . 2.1,01 /0,0899
= 0,01048 L
= 10,48 mL
nO2 = x
VO2 = nO2 . MO2./ O2
= 7,77. 10-5. 2. 15,99 /1,425
= 0,00523 L
= 5,23 mL
Théoriquement
Expérimentalement
VH2 (mL)
10,48
10,8
VO2 (mL)
5,23
5,5
Les écarts relativement petits sont dus d’une part à la lecture des graduations lors
du relevé de volume de gaz, et d’autre part aux imprécisions de l’intensité du
courant et de la tension du générateur.

Sarah Garçon TP de Chimie Inorganique Magistère PCM
Brahim Zardoua
- 4 -
II – Propriétés physiques
1. Paramagnétisme
Schéma du dispositif
Observations
Lorsqu’on verse le dioxygène liquide sur l’entrefer, il est retenu entre les deux
aimants.
Lorsqu’on verse l’azote liquide sur l’entrefer, il n’est pas retenu et tombe.
Lorsqu’on vers « l’air liquide » sur l’entrefer, il est retenu entre les deux aimants.
Interprétations
Dans le tube à essai contenant de l’air liquide, les proportions du O2 et du N2 ne sont
pas les mêmes que dans l’air gazeux (1O2 pour 4N2). En réalité, il y a plus de O2 car à
-196°C il se condense totalement, ce qui n’est pas le cas du N2 de l’air. Avec de
l’azote liquide on ne peut pas refroidir beaucoup de N2. Cela explique donc le fait que
ce mélange de O2 et N2 soit retenu dans l’entrefer de l’électro-aimant.
On remarque qu’il y a des dépots de « neige » sur le bord du vase de Dewar. Cela
provient en réalité de la vapeur d’eau contenue dans l’air de la pièce (humidité), ainsi
que du CO2 solidifié : de la neige carbonique.
On condense le dioxygène liquide avec l’azote liquide. En effet, ce dernier existe à une
température de -195,79°C ce qui est en dessous de la température de condensation di
dioxygène (-182,96°C). Si on met un tube à essai avec une arrivée de dioxygène dans
un vase de Dewar contenant de l’azote liquide, le dioxygène arrivant dans le tube à
essai se condense sur les parois et devient liquide.
On peut également obtenir du dioxygène liquide par distillation de l’air liquide.
Propriétés de O2 et N2 :
O2
Spin=1
La molécule de dioxygène possède deux
couches électroniques ouvertes, soit
deux électrons célibataires. Ainsi, le
dioxygène est paramagnétique : il est
attiré par un aimant.
N2
Spin=0
Le diazote a toutes ses couches
électroniques fermées, aucun électron
n'est célibataire. Il n'est donc pas attiré
par un aimant car il n'est pas
paramagnétique. Il est diamagnétique, et

Sarah Garçon TP de Chimie Inorganique Magistère PCM
Brahim Zardoua
- 5 -
serait même faiblement repoussé par un
aimant de très forte intensité.
Configuration électronique fondamentale de O2 :
12 - 2 - 22 - 12 - 22 - 11 - 2*1 - 20
Les deux électrons qui se trouvent sur les orbitales 11 et 2*1 sont célibataires. Cela
implique l’existence d’un moment dipolaire magnétique, et donc d’un paramagnétisme
de la molécule. D’où le fait de l’attirance par un aimant.
2. Structure électronique : le dioxygène singulet
Schéma du dispositif
Observations
Lorsque l'on ouvre le robinet lentement pour faire passer le dichlore dans la pipette,
on constate la formation de bulles luminescentes qui remonte le long de l’éprouvette.
De plus l’éprouvette est très chaude au touché.
Interprétations
Les bulles luminescentes dans la solution sont dues à la formation d'une espèce
particulière : le dioxygène singulet excité O2*.
Les réactions chimiques à l'origine de la formation de l'oxygène singulet sont les
suivantes :
D'abord, le dichlore se dismute en milieu basique :
2OH- + Cl2 (g) 2Cl- + H2O
Ensuite, l'hypochlorite formé ClO- réagi avec l'eau oxygénée
H2O2, ce qui est confirmé par les potentiels standards :
H2O2 = O2 + 2H+ + 2e-
ClO-(aq) + 2 H+ + 2e- = Cl- + H2O
H2O2 + ClO-(aq) O2*(g)+Cl-(aq) + H2O
L’oxygène singulet 1O2* une molécule riche en énergie,
 6
6
 7
7
 8
8
1
/
8
100%