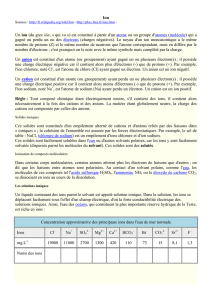
1. Exemple de l`atome d`aluminium

17/04/2017 769804346 1/4
2nde
Thème : Univers
Activités
CHIMIE
Des atomes aux ions
Chap.4-5
I. Rappel : Représentation du noyau
1. Exemple de l’atome d’aluminium
1.1. L’atome d’aluminium est constitué de 13 protons, de 14 neutrons et de ............ électrons.
Pour représenter le noyau de l’atome d’aluminium, les chimistes utilisent la notation suivante : A;ZX
1.2. Indiquer ce que représente chaque partie de ce symbole : 27;13Al
13 est le nombre de ...................................
27 est le nombre de ................................... c’est à dire le nombre de ..................... + le nombre de ............
Al est le symbole de l’élément chimique ................................................
1.3. Entraînement : Compléter le tableau suivant. Remarque pour le compléter : les éléments chimiques qui ont
le même nombre de protons portent le même nom.
Symbole du
noyau
Nom
Nombre de
protons
Nombre de
nucléons
Nombre de
neutrons
Nombre
d’électrons
Charge du
noyau
Charge du
nuage
électronique
Charge
totale
27;13Al
............
............
............
............
............
+ ........ e
- ...... e
............
…;…He
hélium
2
4
…;…H
1
0
…;…O
16
8
…;……
chlore
35
+17 e
…;……
37
20
2. Isotopes et éléments chimiques
2.1. Renseignements à connaître
On donne le nom d’élément chimique à tous les noyaux qui ont le même numéro atomique Z.
Deux éléments chimiques ayant le même numéro atomique ont le même nom et le même symbole X.
Des éléments chimiques qui ont le même numéro atomique Z mais un nombre de nucléons A différent sont
appelés des isotopes.
2.2. Combien y a-t-il d’éléments chimiques différents dans le tableau précédent ? ............
2.3. Quels éléments chimiques de ce tableau sont isotopes ? ................................................
II. Répartition des électrons
1. Couches électroniques
Dans un atome, les électrons sont répartis en couches électroniques notées K, L, M … etc.
Règle de remplissage des couches (valable pour les éléments dont Z 18)
Couche
K
L
M
nombre n
1
2
3
nombre maximal d’électrons
2
8
18
On remplit d’abord la couche K, puis la couche L puis la couche M…
Exemple : atome de sodium 11Na : Z = 11 = 2 + 8 + 1 d’où la structure électronique K(2)L(8)M(1)
1.1. Pour les matheux : quel est le lien entre le nombre maximal d’électrons et le nombre n ? ............

17/04/2017 769804346 2/4
2. Un peu de vocabulaire
Lorsqu’une couche électronique est pleine, on dit qu’elle est saturée.
La couche externe est la dernière couche électronique remplie.
Une couche est dite interne lorsqu’elle n’est pas la dernière couche remplie.
3. Entraînements
3.1. Ecrire la structure électronique en indiquant le nombre d’électrons sur la couche externe.
Elément
Nom
Structure électronique
nombre d’électrons sur la couche externe
1;1H
4;2He
7;3Li
16;8O
3.2. Vrai ou Faux
Un atome dont la structure électronique est K(2)L(5) possède 5 électrons dans son nuage électronique.
..........
La couche L est saturée lorsqu’elle comporte 18 électrons. ............
Deux éléments qui ont le même nombre d’électrons ont la même structure électronique. ............
III. Des atomes aux ions
1. Qu’est-ce qu’un ion ?
C’est le chimiste suédois Svante August Arrhenius qui fut le premier, vers 1880, à découvrir que
certaines substances en solution se trouvent sous la forme d’ions et non de molécules.
Un ion est un atome qui a gagné ou perdu un (ou plusieurs) électron(s).
Pour qu’un atome gagne un (ou plusieurs) électrons(s), il faut qu’un autre atome lui en donne un
(ou plusieurs).
2. Exemple du sel de cuisine
On extrait le sel de cuisine dans les marais salants et les mines de sel. On peut le fabriquer artificiellement au
laboratoire : on fait réagir le métal sodium Na avec le gaz dichlore Cl2 (la réaction est violente !). Il se forme à
la fin de la transformation du chlorure de sodium : c’est un solide constitué d’ions sodium Na+ et d’ions
chlorure Cl-.
2.1. Compléter le texte suivant avec les mots qui conviennent :
négatifs ; chlorure ; perdu ; sodium ; gagné ; chlore ; Na+ ; Cl - ; positifs ; e- (certains mots peuvent être
utilisés plusieurs fois)
Formation des ions ..........................
Formation des ions .............................
Les atomes Na se transforment en ions ............
Les ions ............ sont des atomes de ........................
qui ont ............ un électron
Ce qui s’écrit : Na ............ + ............
Les atomes Cl se transforment en ions ............
Les ions ............ sont des atomes de ......................
qui ont ............ un électron
Ce qui s’écrit : Cl + ............ ............
2.2. L’électron gagné par l’atome de ..................................... a été donné par l’atome de ........................................
2.3. Pour que la matière reste électriquement neutre, des ions .......................................... sont toujours associés à
des ions ..........................................

17/04/2017 769804346 3/4
3. « La matière est électriquement neutre »
On ne peut pas trouver d’ions isolés : les ions positifs sont toujours accompagnés d’ions négatifs.
3.1. La matière peut être constituée d’ions positifs appelés ................................................ et d’ions négatifs
appelés ................................................ dont les charges électriques se compensent.
3.2. Pour mémoriser le nom des ions positifs et celui des ions négatifs, comparer le nombre de lettres de chacun
des mots. En déduire le moyen de mémorisation
...............................................................................................................................................................
...............................................................................................................................................................
4. Ce qui explique la charge des ions…
Pour ressembler aux gaz nobles (ou rares)
Les gaz nobles (rares) sont constitués de molécules monoatomiques et présentent une grande inertie
chimique. Ils sont très stables. Ce sont l'hélium (He), le néon (Ne), l'argon (Ar), le krypton (Kr).
He : K(2) ; Ne : K(2)L(8) ; Ar : K(2)L(8)M(8) ; Kr : K(2)L(8)M(8)N(8)
Règle du duet : Les atomes dont le numéro atomique est voisin de 2, auront tendance à prendre la
configuration électronique stable à deux électrons.
Règle de l'octet : Les autres auront tendance à prendre une configuration électronique à 8 électrons.
5. Les ions monoatomiques
L'application de ces règles permet d'expliquer la formation des ions monoatomiques positifs ou négatifs
5.1. Compléter le tableau suivant :
Atome
structure électronique
de l’atome
structure électronique
de l’ion
même structure
électronique que
Symbole
de l’ion
Ex : Li
K(2)L(1)
perd un e–
K(2)
He
Li+
F
K(2)L(7)
............
............
Mg
K(2)L(8)M(2)
.......... 2 e–
............
O
K(2)L(6)
.......... 2 e–
............
Al
K(2)L(8)M(3)
.......... 3 e–
............

17/04/2017 769804346 4/4
IV. Les composés ioniques
1. Corps simple, corps composé, mélange
Corps simple : c’est un corps constitué d’un seul type d’atomes (ex : Fe, O2, Al3+)
Corps composé : c’est un corps constitué de plusieurs types d’atomes (ex : Fe2O3, HO-, H2O)
Mélange : c’est un ensemble de corps simples et de corps composés (ex : pétrole, plâtre, lait)
2. Les principaux corps ioniques
2.1. Compléter le tableau suivant :
cations
formules
anions
formules
ion fer II
Fe2+
ion sulfure
S2-
ion fer III
ion sulfate
Al3+
NO3-
ion cuivre II
ion carbonate
Zn2+
ion hydrogénocarbonate
HCO3-
Na+
Cl-
Ca2+
ion oxyde
K+
ion hydroxyde
HO-
ion hydrogène
ion magnésium
Ag+
ion baryum
Ba2+
ion ammonium
NH4+
3. Ecriture de la formule chimique du solide ionique
L’oxyde d’aluminium est formé d’ions aluminium Al3+ et d’ions oxyde O2-.
Le composé ionique est toujours électriquement neutre : il y a autant de charges positives que de charges
négatives.
3.1. En déduire la proportion de chaque ion : Il faut ............ ions aluminium pour ............ ions oxyde
Mettre en 1er l’ion positif sans sa charge avec en indice le chiffre trouvé ci-dessus.
Mettre en 2ème l’ion négatif sans sa charge avec en indice le chiffre trouvé ci-dessus.
3.2. Ecrire la formule chimique des ions présents dans le solide ionique : ............
Il est donc impossible de modifier une formule.
3.3. Exemple : nitrate d’argent
La formule de l’ion argent est toujours : …………………
La formule de l’ion nitrate est toujours : ………………….
Formule du solide ionique : …………………………….
3.4. Autres exemples de solides ioniques
Hydroxyde de cuivre II
nitrate d’argent
sulfate de baryum
carbonate d’ammonium
Chlorure de cuivre II
carbonate de calcium
sulfate d’ammonium
Nitrate d’aluminium
1
/
4
100%