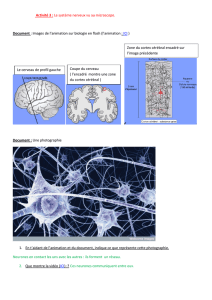
SNC : La cell neurale

SNC : La cell neurale
Généralité : Stockage et traitement de l’information après l’avoir intégrée via les éléments sensoriels.
Organisation spécifique :Réseau, neuromédiateur, excitabilité, SNC, SNP
SNP : Nerf + muscle permet de percevoir, assurer une motricité et de donner des ordres moteurs ou
sensoriels aux organes
SNC : Cerveau + moelle
SNC : Neurones, Astrocytes, Oligodendrocytes, vaisseaux, Microglie, macrophages et lymphocyte.
élément d’origine neuro-ectodermique + élément qui existent dans tout les organes (vascu, reaction
immuno )
SNP : Neurone périphérique, les cells de Schwann qui entourent ces neurones et les cells muscu.
Adhésion inter cell très imp dans le SNC pour assurer l’interaction équilibrée d’éléments cellulaires
différents (neurone, oligodendocyte, odc entre eux.
MBP : myéline basique prot
MAG : myéline associated glycoprotein
Ces molécules d’adhésion s’expriment à la surface des différentes cells et leur interaction permet
d’entrainer un effet colle qui permet de réunir des cells entre elles.
Grand Polymorphisme : ODC dans la SB ou la SG, polymorphisme encore plus grand pour les astrocytes :
protoplasmique ou fibreux.
Les cell gliales :
- Astrocytes : vont jouer un rôle de support mécanique et métabolique des réseaux neuronaux.
Participent à la BHE et assure les échanges métaboliques au sein du tissu nerveux. Existence de
réseaux astrocytaire qui permet la communication des astrocytes entre eux en particulier pour les
seconds messagers comme l’IP3. Joue un rôle imp dans le métabolisme des neuromédiateurs.
- Oligodendrocytes : sont présent au niveau des gaines qui entourent les nerfs au niveau du SNC
gaine de myéline. ( prolongement des astrocytes qui vont entourer les axones des nerfs pour
former une sorte de bulde d’oignon). Au ME : on voit l’imp des adhésions (mol d’adhésion) qui vont
permettre à ces gaines de myéline de rester compactes et d’assurer la protection des neurones. Il
existe des Anticorps ou des maladies contre la MAG sont présent dans le sérum des patients et
peuvent aussi être présent au niveau du SNC. Ces anticorps vont neutraliser les molécules
d’adhésion, vont entrainer une disjonction des gaines de myéline et un disfonctionnement des
communications axonale. (patho important/grave sclérose en plaque (destruction inflammatoire
des ODC du SNC)) ODC participe à l’influx :régulation de la vitesse de l’influx par un meca saltatoire.
Méthode d’étude In-Vitro :
- Culture spécifique des différents éléments cellulaire du SNC (ATC, ODC, neurone embryonnaire (
neurone adulte : post mitotique, qui ne se cultive pas) ou cell neuronale tumorale (comme
neuroblastome) immortalisé et qui peuvent donc être utilisé de façon continu en culture cell.
- Axone géant de calmar : 0.5-1mm de diamètre, plusieurs cm de long, facile d’enregistrer le potentiel
de membrane/potentiel d’action à l’aide de microélectrodes en verre. Introduction d’électrodes au
niveau de l’axoplasme enregistrer des différences de potentiel. On peut injecter facilement dans
l’axoplasme différent éléments pour étudier leur influence sur la dépolarisation.

- Electrophysiologie/Patch clamp (niveau d’étude : cell pro ou eucaryote bien plus petit qu’au
dessus) qui permet de prendre des fragments de membrane. Et à l’échelon cell en utilisant des
microélectrode d’injecter des éléments ioniques permettant de modifier le PA. Différentes tech de
patch clamp qui permettent d’étudier directement la cell, qui permettent d’étudier des fragments
de cell par ex.
- Modifs expérimentales du génome par le transfert de gènes cells génétiquement modifiées,
vecteurs viraux ou non viraux
Dans l’étude du SNC, il est nécessaire de pour être relevant de disposer d’étude in vivo qui permettent
elle, vraiment d’étudier la fonctionnalité du SNC à travers par ex d’analyse comportemental chez
l’animal.
Méthodes In vivo :
- Greffe de cells tumorales dans le snc pour mimer les tumeurs cérébrales ou lésions neuronales qui
peuvent mimer des maladies neurologiques
- Transfert de gènes
- Souris transgéniques
- Souris Knocked-out (invalidées pour un gène spé)
La β-Galactosidase en présence de son substrat donne coloration bleue. Permet de localisaser le
transfert de gènes dans le cerveau et type les types cell qui exprime ces gènes. c’est aussi un gène
contrôle qui est aussi utilisé dans les approches expérimentales.
Il est nécessaire dans le cerveau du fait du polymorphisme cellulaire de bien caractériser les cells qui
expriment le gène.
Pour caractériser les cells on peut faire un immuno-marquage. Prot GFP (Green Fluorescent prot) mais
on est incapable sur image de savoir si la prot s’exprime dans des neurones ou ATC ou dans ODC. Pour le
savoir il va falloir faire des doubles marquages et de la microscopie confocale qui permet de faire des
couches extrêmement mince pour savoir si les immuno marquage se superpose. Ici on a fait un
immuno marquage contre un marqueur des cells astrocytaire : la GFAP ( Coloration rouge des cell
astrocytaire) . Ensuite superposition des deux marquage : rouge + vert orange
L’expression du gène GFAP se réalise dans un protéine astrocytaire. Même type d’expérience
possible avec des Marquages neuronaux ex : anti corps dirigé contre les neuro-filament ou avec
des marqueurs oligodendrocytaires dirigés contre les galactocérébrosides
Dans ces modèles réalisés visant à mimer des maladies neurologiques ou à modifier l’expression de
gène dans le SNC pour en comprendre la fonction. Il est bien sur important de faire plus que
l’observation histologique des tissus, de faire plus que l’observation moléculaire à travers des immuno-
marquages ou d’autre exp de bio-mol, il est important de comprendre l’impact de ces modifs sur le
fonctionnement intégré du SNC. En réalisant des expé d’électrophysiologie qui pourront être réalisée
directement sur l’animal. En implantant des électrodes permettant de mesurer l’activité électrique mais
aussi de faire des études comportementales chez l’animal étudiant par exemples les anomalies du
mouvement, la fonction mnésique chez l’animal et toutes les restrictions qui s’imposent sur
l’extrapolation de ces données. Un des progrès de la biocell a été la capacité d’intégré la bio mol chez le
petit animal et de faire de l’imagerie du le petit animal ce qui est essentiel pour avoir de bon modèles de
maladies neurologiques.
On peut faire de l’imagerie neurologique chez le petit animal : IRM spé pour le petit animal
On peut aussi faire de l’imagerie fonctionnel chez l’homme ou chez l’animal en utilisant de la RMN
Fonctionnelle ( RMN F) qui localise en même temps qu’une tache spécifique est réalisée. Localise donc
des modifs de la vascularisation cérébrale. On regarde donc par ex les modifications contemporaines
d’une tache motrice, on va voir que s’allume une hyperactivité au niveau du cortex moteur. Ce type
d’expé peut être fait pour des fonctions bcp plus complexe comme la reconnaissance visuelle. On peut
aussi utilisé le Pet Scan en utilisant des molécules marquées qui vont par exemple avoir une spécificité
de neuromédiateur on va donc regarder les modifs d’expression dans les maladies neurologiques.

C’est donc des possibilités d’imageries moléculaires in vivo chez l’animal et chez l’homme qui sont
aujourd’hui réalisable. Imagerie des récepteurs pour les neuromédiateur, imagerie pour la synthèse des
neuromédiateurs ect ... imp pour intégrer des éléments moléculaires dans la complexité de
fonctionnement du SNC. On peut aussi réaliser de l’imagerie fluorescente.
Ex imagerie moléculaire : Animal lésé au niveau du striatum avec une neurotoxine : acide iboténique.
Lésion neuronal va être quantifié in vivo à l’aide d’un ligand : l’épidépride marqué à l’iode 123. Au
niveau du striatum contrôle : fix imp de ce ligand . Au niveau du striatum lésé : diminution du marquage
qui caractérise les lésions neuronales par l’acide iboténique.
BHE : moins rigide que « barrière », elle protège le SNC, plus méca de régulation homéostasique. Les
vaisseaux/capillaires dans le SNC sont des capillaire qui ne sont pas fenestré mais qui présentent des
jonctions sérrées.
Coloration Bleu évance ( ???) par intra veineuse : marque un nombre important d’organe mais
marquera pas le SNC parce que ses jonctions serrées l’empêche de passer les capillaires sanguins
La BHC fait intervenir différents éléments cell :
- Neurone : doit être protégé et doit au niveau énergétique garder un niveau identique quelque soit
les conditions d’utilisation de ce neurone. Phénomène homéostasique essentiel caractéristique du
SNC. D’un point de vue physio il est impensable qu’il y ai des baisses d’efficacité fonctionnelle de
ces cells. Ce qui est très différent des autres cells du SNP. Effort Crampe, impensable dans le SNC
ou les mécanismes sont la pour éviter ces déficiences transitoire.
Ce qui permet cette homéostasie et protection : la cell neuronale est isolé de la cell endo, la cell
endo présente des jonctions serrées qui empêche la pénétration dans le SNC d’un nombre
important de molécules. L’intermédiaire entre les deux : ATC qui va médier, réguler les échanges
en fonction des signaux venant en particulier de la périphérie.
Avantage de la BHE : protection contre les facteurs infectieux, contre drogue (potentiellement
neurotoxique), contre substances toxiques présentes dans l’environnement
Désavantage : mauvais passage des drogues anti-infectieuse, des chimiothérapies.
Ex : en cas de méningite si on ne donne pas d’antibio qui passent la BHE antibio qui n’atteindra
pas sa cible patient va développer une infection qui risque de devenir létale faute médicale.
Ex : en cas de leucémie : risque imp de localisation de cell tumorale dans le SNC : prévention d’une
localisation cérébrale en injectant directement au niveau du liquide céphalorachidien(cavité présent
au niveau du SNC) la chimiothérapie concentration intra cérébrale de chimiothérapie qui ne
serait pas possible par administration intra-veineuse.
Microglie : A différencier de la macroglie, Origine médullaire (provient de la Moelle
hématopoïétique et pas d’origine neuroectodermique) les cells microgliales sont les macrophages
du SNC, démonstration par expérience de greffe de cellule marquées radioactivement à la
périphérie (Expé : Injection de moelle ac produit radioactif chez la souris, on attend qq semaines. Et
on a regardé le cerveau pour voir si il y avait des cells radioactive qui aurait le phénotype de cell
microgliale la plupart des cell microgliale dans le cerveau étaient radioactive origine
Hématopoïétique) . En présence d’une lésion cérébrale on déclenchait un afflux extrêmement imp
de cells microgliale . Ne fait pas partie de la neuroglie. Imp car elles Réalise la plupart des fonctions
immunitaire dans le cerveau et elle montre que le privilège immuno du SNC est un faux privilège.
Il y a des réactions immunitaire le cerveau, il a des immunoglobulines dans le cerveau, il y a des
lymphocyte dans le cerveau et des cells microgliale.
Les neurones : cell excitable (propriété électrique, toutes les cells sont dépolarisables mais les neurones
exprime un niveau de différentiation préférentielle pour cette fonction d’excitabilité cellulaire ), les
neurones sont des cells spécialisées ( il existe des 100aines de types de neurones ), notion de réseau
(imp) qui communique par l’intermédiaire de communication inter-cell via des neurotransmetteurs.

Structures des neurones : Corps cell + dendrite + axone (entouré de gaines de myéline réalisé par les
ODC)
Il existe sur le plan morphologique une énorme diversité neuronales (énormément de prolongement,
peuvent être très long (motoneurone pyramidaux) ou de petite cell ( inter-neurone)
Classification morphologique : Unipolaire, bipolaire, pseudo-unipolaire , multipolaire
Classification par implication fonctionnel : neurones : moteurs, sensoriel, interneurones (régule la
fonction des neurones en faisant des connections entre des neurones qui ont des fonctions spé.
Marquage des neurones avec anti-neurofilament ou coloration argentique. Marquage ATC avec Anti-
corps anti GFAP.
Ce qui est important dans le neurone : l’existence de réseaux qui vont associer un communication
électrique à une communication chimique.
Dentrite (E) -> axone (E) -> Synaspe (C) -> Dentrite (E) ……
Communication chimique :
- Les cell neuronales sont électriquement isolées
- Les transmissions chimique se font au niveau des synaspes
- Médiateur de la transmission chimique : neuromédiateur
- Vésicule synaptique contiennent les NM.
- Bcp de mitochondrie car importante activité métabolique
- Golgi qui va donner lui aux vésicules de NM
Les éléments imp : postS , pré-S , l’existance de vésicules qui contiennent les NM qui vont être libéré au
niveau de la fente synaptique et qui font de lier sur un récepteur postS.
La synaspe : une cell préS + une cell postS + influx nerveux qui arrive à la terminaison axonale
libération de vésicules de NM relargué au niveau de la fente nouvel influx nerveux dans la cell postS .
L’influx nerveux est initié par la libération d’un NM, il a son origine dans l’activation d’un récepteur. Qui
passe d’un état de repos à un état activé grâce à la liaison d’un NM issue des vésicules de la région préS.
Méca qui permettent de transformer un signal chimique en signal électrique et vice versa :
- Au niveau PréS : l’entré de Ca2+ déclanché par influx nerveux libération des vésicules.
- Par sa fixation à un récepteur canal, le NM va permettre l’entrée de d’ions (NA+) ce qui va modifier
la polarisation membranaire.
Les NM : médiateur chimique de l’influx nerveux au niveau de la synapse. Il assure une modif de la
polarisation membranaire postS par l’intermédaire d’un canal ionique controlé par un NM
Ex de NM : Acétylcholine, Dopamine, GABA, Glutamate, Sérotonine
La communication synaptique et la neurotransmission doit être régulée de façon fine, les meca de
régulation comprennent la dégradation par des enzyme et le recaptage par les cells préS et les cells
gliales.
La communication synaptique va permettre de modif la composition ionique du milieu extra cell (Na+ /
Cl-) et intra cell (K+ / Prot - ), l’entré via les canaux des molécules extra cell va entrainer une
dépolarisation et un Potentiel membranaire.
PPSE : potentiel postS excitateur: entrée d’ion Na+ dépolarisation (car entrée d’ion NA+)
PPSI : Potentiel postS inhibiteur: entrée d’ion Cl- hyperpolarisation

Synapse activatrice : Acétylcholine, Glutamate, sérotonine
Ouverture des canaux cationiques (augmentation de NA intra cell dépolarisation
membranaire)
Synapse inhibitrice : GABA, Glycine
Ouverture des canaux Cl- (maintient de la polarisation postS)
Notion de neuropeptides :
- Effet plus lent
- Effet plus prolongé
- Notion de neuromodulation
- Ex : Met-enkephaline, vasopressine, substance P
NP sont dans des vésicules larges, ils vont se fixer sur des RCPG (pas R-canaux), pas de recapture, existe
sous forme de précurseur présent dans les grosses vésicules. Les NP doivent être coupé par des enzymes
(endopeptidases) pour libérer le peptide actif.
Au pt de vue fonctionnel : les NP interviennent dans des méca neuronaux ou la rapidité n’est pas le 1er
objectif (ex : régulation de la douleur, imp d’avoir un effet qui dur plus longtemps)
GABA est un système de synapses inhibitrices, il est issue de l’aspartate, enzyme imp dans son
métabolisme : GAD, qui permet de transformer le glutamate en GABA. Comme tout les NM des vésicules
de GABA sont libérés sous l’effet d’un PA qui a généré l’entrée de Ca2+.
Aspartate Glutamate GABA
Régulation : d’abord recapture qui va permettre de recycler le GABA dans les vésicules de Nm, mais
aussi recapture par les ATC mais aussi par la dégradation par des enzymes.
GABA quand se fixe sur son récepteur : induit l’entrée de cl maintient la polarisation membranaire.
Comprendre la fonction d’un R, c’est comprendre ce qui va pouvoir venir se fixer sur ce R. Bcp d’étude
ont été fait pour les récepteurs pour les NM grâce à la crystalographie (technique qui permet de
prendre les récepteurs et d’en déterminer la structure tridimensionnel, à partir de cette structure 3D on
peut prévoir des zones qui vont venir lier des agonistes spécifiques.
Le récepteur GABA-A est un Glycoprot TM, formé de 4 s-u (Alpha, beta, gamma, delta), agoniste :
muscimol ou la bicuculline et des antagoniste : picrotoxine. Chez l’animal, l’antagoniste des GABA-R
peut entrainer des crises d’épilepsie. GABA-R joue un rôle dans la régulation de l’excitabilité
neuronale on peut utiliser l’activation du GABA-R pour réguler de l’hyperexcitabilité neuronale
(dépolarisation incontrôlée des neurones décrite chez les patients atteint de crise d’épilepsie)
Le 2nd intérêt de connaitre la structure 3D c’est de pouvoir inventer des ligands qui vont venir se lier sur
ce R, qui vont venir modifier sa conformation pour l’activer ou l’inhiber à visée thérapeutique. On peut
aussi par le biais de sa structure 3D comprendre pourquoi certaine molécules ont des effets secondaires
à travers leur liaison au récepteur.
Le récepteur GABA-A présente des sites récepteurs capables de reconnaitre des substances
pharmacologiquement actives : benzodiazépines (BZDs), barbituriques, les neurostéroïdes, les
convulsivant, l’alcool ( explique l’effet favorisant de l’alcool sur les crises d’épilepsie)
Ces substances interagissent de manière allostérique
Neurone dopaminergique : NM : dopamine issue du métabolisme de la tyrosine
Tyrosine L-DOPA grâce à Tyrosine hydroxylase Dopamine grâce à DOPA décarboxylase Nor
Adrénaline
 6
6
 7
7
 8
8
1
/
8
100%