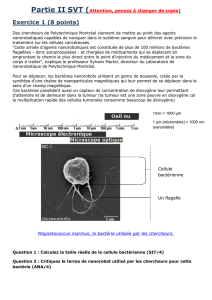
C 31-32, Mr. ALPY Fabien Cours du 24/10/11 de 14h à 16h Groupe

AN01 Page
1
sur
1
C 31-32, Mr. ALPY Fabien
Cours du 24/10/11 de 14h à 16h Groupe 17
DCEM 1 Pine d’Huître et La Buche
________________________________________________________________________________
Biologie de l’invasion et de la métastase
I/ La matrice extra cellulaire (MEC)
Elle est située entre les cellules.
La proportion de la MEC est variable selon les organes.
Il y a 2 types de MEC : - la lame basale composée essentiellement de laminine α1, elle
sépare l’épithélium du tissu conjonctif (TC)
- la matrice stromale composée essentiellement de collagène 4,
c’est un composant du TC
A/ Les molécules de la MEC :
Elles favorisent l’adhésion mais ont aussi des propriétés anti adhésives. Elles ont des
fonctions de structure et d’information.
Ex : les cytokines aident au renouvellement de la MEC en transportant l’information aux
cellules de la MEC
B/La lame basale(LB) :
Elle est composée de collagène et de la laminine. Les laminines interagissent entre elles tout
comme le collagène et ces deux réseaux interagissent entre eux grâce à des molécules
spécifiques (perlecans, nidogène)

AN01 Page
2
sur
2
C/Le rôle de la MEC :
Rôle de : - structure
- barrière entre les tissus
- séquestration des composants
- informations modifiant le comportement des cellules (adhésion,
différenciation…)
S’il y a une mutation des protéines de la lame basale elle perd ses
fonctions.
II/Le cancer du sein
A/Epidémiologie :
Cancer le plus fréquent chez la femme, 11000 décès/an. Le taux de mortalité diminue mais
l’incidence du cancer augmente (dépistage)
B/ Anatomie de la glande mammaire (GM) :
Les tumeurs se développent au niveau des cellules épithéliales de la GM.
L’épithélium comporte deux types cellulaires :
- les cellules luminales (en contact avec la lumière du tubule)
- les cellules myoépithéliales (en périphérie)
Les cellules luminales produisent le lait et les cellules myoépithéliales permettent la
contraction de la glande pour l’éjection du lait.
C/La tumeur, un organe complexe :
Il existe une interaction fonctionnelle entre les cellules cancéreuses et les cellules du stroma
(fibroblastes, cellules endothéliales, péricytes…)
Les cellules cancéreuses émettent des signaux vers les cellules normales, qui, en réponse
vont promouvoir le développement de la tumeur. Donc, même si ces cellules ne sont pas
cancéreuses, elles favorisent le développement de la tumeur.
On a trois grands groupes de cancer du sein :
- La majorité est de type luminal, caractérisée par la présence d’un
marqueur qui est un récepteur aux œstrogènes nucléaires : ERα.
La tumeur est hormono-dépendante.
Stratégie thérapeutique par blocage des récepteurs aux
œstrogènes (ex : tamoxifène). On a un bon pronostic.
- Par altération du récepteur membranaire ERBB2 qui s’active de
manière continue. Mécanisme hormono-indépendant, thérapie
possible avec des Ac monoclonaux. On a un mauvais pronostic.
- Tumeur hormono-indépendante, ne concernant pas les deux
récepteurs précédents : ERα-, ERBB2-. Thérapie cytotoxique pour
tuer les cellules. Mauvais pronostic.

AN01 Page
3
sur
3
D/Histoire naturelle du cancer :
Etapes du processus tumoral :
- Altération des cellules
- Tumeur in situ
- Invasion primaire par franchissement de la lame basale et invasion
du TC
- Métastase par passage des cellules dans le secteur vasculaire
(sang ou lymphe) et atteinte de l’organe cible
Il existe des sites privilégiés pour la colonisation = tropisme (ex : pour le cancer du sein :
tropisme pour les ganglions axillaires, les poumons, les os, le cerveau, foie et colon)
Le tropisme de ces cellules cancéreuses provient de deux mécanismes :
- Physique : les cellules vont se bloquer aux endroits où les
capillaires sont fins (ex : poumons)
- Interaction entre cellules tumorales et cellules endothéliales par la
présence de récepteurs.
E/Anapathologie du cancer du sein :
En coupe on voit deux types cellulaires :
- Cellules larges, peu marquées : cellules tumorales
- Brunes, allongées : fibroblastes associés aux tumeurs qui sont
modifiés et qui expriment la stromélysine-3

AN01 Page
4
sur
4
F/Invasion tumorale :
- Perte de la polarité apico-basale des cellules car elles se
retrouvent dans le stroma et non sur une lame basale.
- Perte de l’intégrité de la LB.
- Mélange des compartiments épithéliaux et conjonctifs.
Tout ceci, entraine une desmoplasie c'est-à-dire une constitution d’un stroma tumoral qui est
la source majeure des activités protéolytiques.
III/ Les activateurs du plasminogène
uPA/Urokinase :
La protéine uPA active le plasminogène par son récepteur (uPAR). Le plasminogène va être
clivé par l’uPA pour former la plasmine. La plasmine va aller activer le pro-uPA qui donnera
du l’uPA (auto-activation)
La plasmine dégrade certains composants de la MEC et activent d’autres métalloprotéases
matricielles(MMPs) qui sont sécrétées sous forme de pro-MMPs.
Ce système premet la dégradation des composants de la MEC
Il existe des systèmes d’inhibition :
- Par clivage des récepteurs
- Par inhibition de l’uPA grace à PAI1 et PAI2
- Par inhibition de la plasmine et des MMPs

AN01 Page
5
sur
5
Certains cancers permettent l’augmentation d’activité de l’uPA ce qui entraine une forte
destruction de la MEC et une probabilité de rechute importante.
Pour dépister un cancer on dose l’uPA car elle a une valeur de mauvais pronostic.
IV/ Les métalloprotéases matricielles (MMPs)
A/ Généralités :
Il y a 23 MMPs codées par 23 gènes différents chez l’homme.
Elles ont une architecture commune :
- Domaine catalytique qui lie un ion zinc
- En amont on a un domaine protéique avec un peptide signal (N-
terminal) qui passe dans la voie de sécrétion, et un pro-peptide
(=pro-domaine) qui inhibe l’activité du domaine catalytique. Pour
une activation du domaine catalytique le pro-peptide doit être clivé.
- Domaine hémopexine (C-terminal) permet la reconnaissance du
substrat. Ce domaine donne la spécificité de substrat à l’enzyme.
On a des sous-familles qui possèdent aussi un domaine transmembranaire.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%