Cellule de Nageotte : Mode d'emploi et comptage cellulaire

1/4
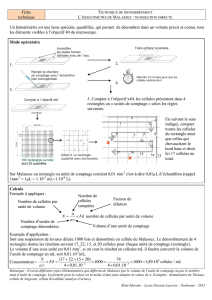
Cellule de Nageotte
Mode d’utilisation
1. Description de la cellule de Nageotte
Caractéristiques de la cellule de Nageotte
Quadrillage total constitué de 40 bandes
Les dimensions d'une bande :
L : 10 mm l : 0,25 mm H : 0,50 mm
Chaque bande a un volume de 1,25 µl

2/4
2. Les principales utilisations de la cellule de Nageotte
La cellule de Nageotte sert essentiellement au comptage des éléments figurés contenus dans
les liquides biologiques dont la densité cellulaire est habituellement faible : LCR, urine …
3. Manipulations qui précèdent le comptage
3.1. Avant de charger la cellule
.De la même façon que l’on procède avec un hématimètre (Thoma ou Malassez) les
bords de la cellule (là où reposeront les bords de la lamelle) doivent être humectés avec
un tout petit peu de liquide afin d’assurer une bonne adhésion de la lamelle : la ma-
nière la plus efficace et la plus pratique consiste à le faire à l’aide d’un doigt dont l’extrémité a
été très légèrement humidifié avec de l’eau ou de la salive.
.Placer une lamelle plane sur la cellule puis appuyer légèrement pour assurer sa
bonne adhésion entre la lamelle et les bords de la cellule
.Poser la cellule sur une surface bien horizontale (par exemple la platine du microscope).
3.2. Introduire le liquide à analyser dans la cellule
.Homogénéiser la suspension cellulaire à analyser
.L’introduire à l’aide d’une pipette Pasteur (ou équivalent) en la laissant pénétrer par
capillarité : la totalité de la surface délimitée par les rigoles doit être recouverte par
la suspension et la suspension ne doit pas déborder dans les rigoles
.Le délai d’attente avant de procéder au comptage ne doit être :
.ni trop court (environ 10 min. sont nécessaires pour que les cellules à compter puissent
sédimenter suffisamment)
.ni trop long (pour éviter un début de dessèchement de la préparation).
Si on craint un dessèchement : placer la préparation à l’horizontale à l’intérieur d’une
chambre humide

3/4
4. Compter les éléments cellulaires. Procéder au calcul de leur nombre par µl
Voir la technique « Liquide céphalo-rachidien. Examen cytologique »
4.1. Avant de faire le comptage
4.1.1. faire une observation à l’objectif x10 non seulement pour repérer le quadrillage
mais aussi pour vérifier que les cellules à compter sont réparties de façon ho-
mogène ; si l’homogénéité est jugée insuffisante il faut tout recommencer,
c’est-à-dire charger une nouvelle cellule de Nageotte à partir de la suspension
réhomogénéisée.
4.1.2. passer à l’objectif x40 pour effectuer le comptage
4.2. Le comptage des éléments
Il est recommandé de compter les éléments (leucocytes, hématies, autres éléments
éventuels) contenus dans 4 bandes au moins, c’est-à-dire les éléments contenus
dans 1,25 x 4 = 5 µl
Remarques :
4.2.1. Il peut être nécessaire de diluer le liquide si le manipulateur considère que les élé-
ments sont trop nombreux pour pouvoir réaliser un comptage précis.
Attention : ne pas oublier le facteur de dilution au moment du calcul.
4.2.2. Un nombre élevé d’hématies peut gêner le comptage des leucocytes. On peut con-
tourner la difficulté de la façon suivante :
.détruire les hématies en diluant au 1/2 le liquide à analyser dans une solution
d’acide acétique à 0,5 pour cent (0,5 ml d’acide acétique pur dans 100 ml d’eau) puis
procéder au comptage des leucocytes
Attention : ne pas oublier le facteur de dilution au 1/2 au moment de calculer le nombre de
leucocytes.
4.2.3. Le comptage des éléments qui chevauchent le côté de 2 bandes contiguës :
ne compter que ceux qui chevauchent l’un des 2 côtés : par exemple le côté droit
4.3. Le calcul du nombre d’éléments
Soit :
V le volume de comptage (V = 5 µl si on a compté les éléments dans 4 bandes)
n le nombre d’éléments (hématies ou leucocytes) contenus dans ce volume V
d la dilution du liquide introduit dans la cellule
Le nombre N d’éléments (hématies ou leucocytes) par µl de liquide se calcule de la
façon suivante :
N = (n / V) x d
1e exemple :
.liquide non dilué : d = 1 n = 72 V = 5 µl (volume de 4 bandes) N = 14/µl
2e exemple :
.liquide dilué au ¼ donc d = 4 n = 550 V = 5 µl (volume de 4 bandes) N = 440/µl

4/4
5. Nettoyage après usage : cellule et lamelle plane
.Immersion pendant 10 à 15 minutes dans un bain d’eau de javel dilué
.Rinçage à l’eau du robinet puis à l’eau distillée
.Essuyage : linge fin ou papier absorbant non pelucheux (genre « Sopalin ») sans frotter
.Laisser sècher à l’air libre durant quelques minutes
.Ranger à l’abri des poussières.
Fin.
Le 20 juin 2008 Joseph Cuziat
1
/
4
100%