1. Techniques du diagnostic direct

Virologie.
Cours d’Inès Masmoudi. DCEM1 2010-211.
METHODES DE DIAGNOSTIC VIROLOGIQUE
- Intérêt diagnostic :
o Preuve de l’origine virale de l’infection.
o Suivi de l’évolution biologique de l’infection.
o Evaluation de l’état immunitaire d’un patient.
o Appréciation de la réponse vaccinale.
o Eviter la transmission de virus au cours de dons d’organes.
o Etude vu virus en cause et de ses variants.
I. Phase pré-analytique
1. Prescription médicale
- Prescripteur obligatoire.
- Patient : nom – prénom – sexe – date de naissance – etc.
- Renseignements complémentaires.
- But de l’analyse.
- Nature des principales manifestations pathologiques :
o Date d’apparition.
o Localisation des lésions infectieuses.
Etat d’immunodépression.
o Pris d’antiviraux, ATB.
o Femme enceinte / date de début de grossesse.
- Voyage récent.
- Vaccination datée.
2. Exécution du prélèvement
- La fiabilité du diagnostic dépend de la qualité du prélèvement (nécessité de présence de cellules
dans le prélèvement).
- Le préleveur doit être clairement identifié : responsable de l’étiquetage des récipients contenant
l’échantillon biologique.
3. Récipients contenant les prélèvements
- Transport dans un sac en plastique.
- Prescription jointe dans un compartiment séparé.
4. Moment du prélèvement
- Infection aigue : début des manifestations cliniques.
- Infection qui ont des durée d’incubation longue (exemple : hépatite B) : si on prescrit une
recherche d’hépatite B durant cette période d’incubation, elle sera négative car absence
d’anticorps anti-hépatite B.
- Mise en évidence d’une primo-infection : période d’incubation habituelle.

Virologie.
Cours d’Inès Masmoudi. DCEM1 2010-211.
5. Site du prélèvement
- En théorie : toute lésion accessible doit être prélevée.
- Utilise de prélever différents sites, correspondant à la porte d’entrée habituelle du virus, et sa
voie d’élimination.
- Détection rapide de virus, culture de virus, recherche de génomes viraux (ARN++) : transport
SANS DELAI au laboratoire. Congélation sous 4h du plasma ou sérum.
- Mauvaises conditions de transport du prélèvement :
o Risque d’altération des cellules infectées.
o Perte de pouvoir infectieux du virus (cultures faussement négatives).
o Dégradation des génomes viraux (PCR faussement négative, sous-estimation de la charge
virale).
o Risque de prolifération bactérienne ou mycosique.
6. Circonstances justifiant un refus d’analyse par le laboratoire
- Le biologiste est responsable des échantillons biologiques acceptés au laboratoire.
- Principales situation de refus :
o Echantillon non étiqueté ou improprement étiqueté.
o Echantillon inapproprié aux analyses prescrites.
o Echantillon reçu dans un récipient endommagé et/ou non étanche.
o Echantillon reçu trop tardivement après avoir été prélevé.
o Echantillon identique à un autre échantillon reçu le même jour.
II. Principes du diagnostic virologique
- Diagnostic direct : mise en évidence du virus.
o De la particule complète.
o D’antigènes viraux.
o De génomes viraux.
o D’une propriété virale.
- Diagnostic indirect : mise en évidence de la réponse spécifique de l’hôte.
o Des anticorps (IgG ou IgM).
o La synthèse d’Interféron. L’interféron est une cytokine particulière produite de façon
systématique lorsqu’une cellule est infectée par un virus.
1. Techniques du diagnostic direct
- Il est réalisé :
o Sur l’échantillon biologique.
o Ou après mise en culture cellulaire. La culture cellulaire permet d’amplifier le virus
présent dans l’échantillon (mais couteuse donc de moins en moins utilisée).
- Les trois types d’analyse en diagnostic direct :
o Recherche de virions.
o Recherche d’antigènes viraux.
o Recherche de génome.

Virologie.
Cours d’Inès Masmoudi. DCEM1 2010-211.
- Recherche de virions au microscope électronique (très cher et long, intéressant pour la recherche
mais pas en diagnostic direct).
- Recherche d’antigènes viraux :
o Immunofluorescence (antigène associés aux cellules).
o Enzyme immuno-Assay, agglutination (antigène solubles).
- Recherche de génomes viraux : PCR, hybridation moléculaire, TMA, bDNA, etc.
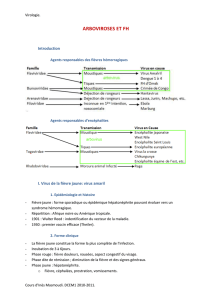
a. Type de prélèvements – virus concernés
Prélèvements
Virus
Selles
Rotavirus ; enterovirus
Adenovirus ; astrovirus
Sécrétions respiratoires
Virus grippaux
VRS ; parainfluenza
Adénovirus
Lésions cutanéo-muqueuses
HSV 1,2
VZV
Sang polynucléaires sérum
CMV
Ag HBs
Ag Hbe
Ag delta
Ag p24 (antigène du VIH)
b. Intérêt et limites de la détection d’antigènes viraux
- Détection directe d’antigènes viraux ne nécessite pas le maintien de l’infectiosité (IF,
agglutination latex).
- Limites : manque de sensibilité ; nécessité de quantités importantes de virus.
- Champs d’application : restreint aux prélèvements riches en matériel infectieux, intérêt : bonne
conservation des structures antigéniques, le prélèvement peut être conservé à 4°C.
c. Techniques de diagnostic direct – méthodes de diagnostic rapide
- Immunofluorescence (IFD directe ou IFI indirecte)
o IFD directe : anticorps primaires spécifiques marqué à la fluorescéine.
o IFD indirecte : anticorps secondaires marqués à la fluorescéine.
- Immunochromatographie :
o Très utilisé pour : le virus de la grippe (influenza virus), virus respiratoire syncytial, etc.

Virologie.
Cours d’Inès Masmoudi. DCEM1 2010-211.
d. Isolement sur culture cellulaire
- Isolement du virus sur culture cellulaire : technique de référence.
o Identification virale : lecture de l’effet cytopathique (ECP). Quand un virus se multiplie
dans une cellule, il crée des désordres dans celle-ci et modifie sa structure. A
l’observation microscopique il est possible de repérer ces modifications morphologiques
de la cellule (vacuoles, forme, etc.).
o Typage du virus (entérovirus, Herpes, simplexvirus).
- Obstacles limitant l’intérêt de la culture :
o Délai de la réponse important.
o Nécessité de disposer de nombreuses lignées cellulaire (coût).
o Prélèvements riches en virus infectieux (acheminement rapide).
- Inoculation de cellules permissives :
o Cellules diploïdes (MRC5).
o Lignées continues (vero, hela, Hep2, MDCK, etc.).
o Historique : souriceau, œuf embryonné, etc.
- Manipulation stérile :
o Matériel adapté.
o Manipulateur expérimenté.
En pratique
- Acheminement rapide.
- Traitement de l’échantillon :
o Directe si stérile.
o Traitement : filtration, isolement cellulaire, broyage, antibiotiques, etc.
- Inoculation d’un panel adapté de cellules.
- ± centrifugation.
- Incubation 37°C (33°C) dans une atmosphère de CO2.
- Mise en évidence de la multiplication virale :
o Recherche d’un effet cytopathique (ECP) :
o Contraste de phase.
o Coloration.
o Immunofluorescence (IF), immunoperoxydase (IP) sur les cellules.
o Biologie moléculaire.
- Culture du cytomégalovirus : ECP lent 15 à 21 jours. Déformation de la nappe en banc de
poisson.
Intérêts et limites de la culture cellulaire
- Isolement viral : intérêt.
o Faire la preuve du caractère infectieux des virus présents dans le prélèvement.
o Pour établir le diagnostic étiologique de certaines infections virales.
o Etudier leu résistance phénotypique aux antiviraux disponibles.
o Réaliser des enquêtes épidémiologiques.
- Quand prélever : le plus précocement possible.
- Ou prélever : au niveau de l’organe cible quand les lésions sont accessibles.

Virologie.
Cours d’Inès Masmoudi. DCEM1 2010-211.
e. Recherche des génomes viraux
- Détection des génomes.
- Quantification des génomes.
- Séquençage des génomes.
- Techniques automatisées +++.
- Très sensibles et rapides.
Techniques de biologique moléculaire
- Mise en évidence du génome viral :
o Techniques d’hybridation.
o Amplification du signal : bDNA (ADN branché).
o Amplification de la cible : PCR.
o TMA (Transcription Mediated Amplification).
o Quantification en temps réel.
- Etudes génotypiques :
o Génotypage de la souche virale : exemple du VHC (LiPA, séquençage, etc.).
o Génotypage de résistance : exemple du VIH, du VHB.
Principes de l’hybridation
Techniques d’amplifications
- Basées sur la réplication : BCR, etc.
- Basées sur la transcription : TMA, etc.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%