5-bases-fondamentales-de-l-oncogenese

Kevin CHEVALIER 1
BASES FONDAMENTALES DE L'ONCOGENESE
I. Introduction
A. Quelques définitions
Le terme tumeur (du latin tumere, enfler) désigne, en médecine, une augmentation de
volume d'un tissu, sans précision de cause.
Les tumeurs peuvent être bénignes ou malignes.
B. Cellule normale et cellule cancéreuse
Il existe plus de 100 types de cancers mais toutes les cellules cancéreuses ont des propriétés
communes. Ces cellules cancéreuses sont insensibles aux signaux et ont des comportements propres
autonomes indépendants des signaux.
Elles ont 6 propriétés :
Indépendance vis-à-vis des signaux de prolifération
Insensibilité aux signaux antiprolifératifs
Résistance à l'apoptose
Prolifération illimitée
Capacité à induire l'angiogenèse (création de vaisseaux, pour apporter de l’oxygène des
nutriments, en outre : nourrir la tumeur)
Capacité d'invasion tissulaire et de diffusion métastatique

Kevin CHEVALIER 2
C. Environnement péri-tumoral
Il existe des cellules non tumorales comme les fibroblastes qui peuvent sécréter des
protéases, des facteurs de croissance, …. On a aussi des vaisseaux pour nourrir la tumeur. La tumeur
peut induire l'angiogenèse, elle est donc plus vascularisée que la moyenne.
II. Cancérogenèse
A. Transformation d'une cellule normale en cellule cancéreuse
1. Agents cancérigènes
Des agents mutagènes (induisant des mutations de l'ADN) et des agents cancérigènes
(induisant des tumeurs) peuvent induire la transformation d'une cellule normale en cellule
cancéreuse.
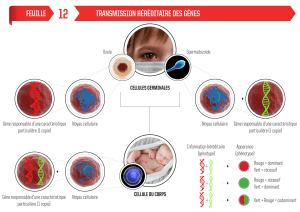
Le cancer résulte d'une anomalie intrinsèque de la cellule, résultat d'altérations de son
génome (ADN). Ces anomalies de l'ADN peuvent être d'origine génétique ou épigénétique
(méthylation de l'ADN) et sont transmises aux cellules filles lors des divisions cellulaires. Elles
surviennent dans 90% des cas dans les cellules somatiques (altérations requises). Dans 10% des cas,
elles surviennent dans les cellules germinales donnant lieu à des prédispositions héréditaires aux
cancers.
2. Agents conduisant au développement d'un cancer

Kevin CHEVALIER 3
Une injection unique de DMBA ne conduit à aucun changement phénotypique. Par contre l'injection
successive de DMBA à intervalle régulier entraîne l'apparition de tumeur.
Une injection unique de DMBA suivi d'injections a intervalles réguliers de TPA induit une tumeur.
Une injection répétée de TPA puis une injection unique de DMBA ne change rien.
L'injection unique de DMBA puis l'injection répétée à long intervalle de TPA, ne donne pas de
changement.
Ainsi, le DMBA est un agent initiateur et le TPA est un agent promoteur.
Les agents initiateurs sont des agents qui induisent une lésion définitive de l'ADN (par exemple une
mutation). Ce sont des agents génotoxiques (carcinogènes chimiques, virus, radiations ionisantes).
Les agents promoteurs n'induisent pas de lésions de l'ADN mais favorisent l'expression d'une lésion,
préalablement induite par un agent initiateur.
B. Caractéristiques multi-étapes du cancer
1. Cycle d'altération de l'ADN/sélections
Une tumeur est issue d'une même cellule (on parle de monoclonalité).
L'accumulation de plusieurs événements génétiques ou épigénétiques,
rares et indépendants, est nécessaire à la transformation d'une cellule
normale en cellule tumorale.
Le développement d'une tumeur procède à des cycles d'altération de
l'ADN / sélection.
2. Instabilité génétique
La cellule normale possède de nombreux systèmes de contrôle veillant à l'intégrité de son
génome (Exemple : anomalies caryotypiques).
3. Vieillissement et développement tumoral
Le vieillissement péritumoral (environnement de la tumeur) et le vieillissement du système
de correction font que l'on a des erreurs de réparation de l'ADN

Kevin CHEVALIER 4
4. Cellules souches tumorales
Ces cellules souches tumorales sont des cellules initiatrices de tumeurs, définies par leur
capacité à s'auto-renouveler et à maintenir la croissance de la tumeur et son hétérogénéité. Ces
cellules rares sont dans des niches où elles restent quiescente en dormance. Un jour, un signal ou
une situation entraîne la prolifération de ces cellules entraînant une tumeur.
C. Gènes impliqués dans l'oncogenèse
1. Oncogène et gène suppresseur de tumeur
Un oncogène est un gène altéré, dont le produit (protéine) est impliqué dans la
transformation d'une cellule normale en cellule tumorale. L'équivalent cellulaire normal de ce gène
est appelé proto-oncogène. L'oncogène peut être altéré de différentes façons (mutations,
amplification…) et cette altération aboutit à un gain de fonction. Il suffit qu'un seul des 2 allèles soit
altéré pour observer l'effet oncogénique (mode dominant).
Un gène suppresseur de tumeur (Exemple : P53) est un gène dont la perte de fonction est
impliquée dans la progression tumorale. L'altération du gène suppresseur de tumeur aboutit à une
perte de fonction de la protéine correspondante, les 2 allèles du gène devant être altérés pour
observer l'effet oncogénique (mode récessif).
2. Gènes suppresseurs de tumeurs
Ces gènes suppresseurs de tumeurs (tumor suppressor genes) constituent lorsqu'ils sont
actifs, de véritables "verrous" protecteurs empêchant la transformation tumorale de la cellule. Les
gènes suppresseurs de tumeurs peuvent être classés en 2 familles de gènes.
a. Les gènes impliqués dans le contrôle de la prolifération et de la survie (gatekeepers)
Les principaux gènes suppresseurs de tumeur de cette famille sont, par exemple : pRb
(protéine du rétinoblastome) et p53.
Ces gènes sont apparus tardivement au cours de l'évolution (chez les eucaryotes
pluricellulaire) et protègent la cellule contre la transformation tumorale en régulant le cycle
cellulaire contre l'apoptose.
Pour de tels gènes, la réintroduction dans la cellule cancéreuse d'un gène fonctionnel
abouti à une réversion du phénotype tumoral.

Kevin CHEVALIER 5
b. Les gènes du maintien de l'intégrité du génome (caretakers)
Ces gènes contrôlent la stabilité et l'intégrité du génome cellulaire. On les retrouve dans
tous les organismes vivants, des procaryotes aux humains.
L'altération des 2 allèles de ces gènes conduit à une susceptibilité accrue aux cancers par
instabilité génétique (accumulation de mutations).
Contrairement aux gènes suppresseurs de tumeurs contrôlant la prolifération et la survie
cellulaire, la réintroduction d'un allèle normal n'entraîne pas, pour ces gènes, de réversion du
phénotype tumoral. Ils agissent en amont des gènes cités précédemment permettant leur activation
(oncogène) ou leur inactivation (gatekeepers).
Exemples de gènes de maintien de l'intégrité du génome : BRCA1 (cancer du sein), ATM
3. Premiers oncogènes
Les premiers oncogènes identifiés par cette approche appartiennent à la famille Ras (H-ras,
N-ras). Le proto-oncogène correspondant, c-ras, code pour une GTPase monomérique impliqué dans
la signalisation cellulaire. H-ras et N-ras sont des formes mutées de c-Ras aboutissant à une protéine
hyperactive.
Les oncogènes de la famille ras sont fréquemment retrouvés dans les cancers humains (25%
des cancers environ).
L'approche par transformation cellulaire a permis de mettre en évidence des oncogènes
préalablement identifiés par l'approche rétrovirale ainsi que de nouveaux oncogènes.
4. Transformation cellulaire
La transformation cellulaire correspond à l'acquisition par une cellule, d'un ou plusieurs
caractères propres à la cellule tumorale. Ceci se manifeste en culture par un phénotype cellulaire
particulier comprenant la perte de l'inhibition de contact, la perte de la dépendance vis-à-vis de
l'ancrage, la perte de l'indépendance vis-à-vis des facteurs de croissance, l'immortalité et
l'induction de tumeurs dans des modèles animaux.
III. Cytogénétique des cancers
A. Origine
Des remaniements (translocations) chromosomiques, souvent uniques, sont fréquemment
observés dans les leucémies humaines (environ 65% des leucémies), telle que la translocation t(9,22)
dans la leucémie myéloïde chronique. Ces translocations conduisent à une sous ou une
surexpression génique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%