Mises en évidences des rôles des protéines 14-3

Mises en évidences des rôles des protéines 14-3-3σ
Cours du 23 Septembre 2008 : MD4
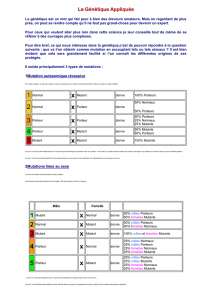
Ces protéines ont d’abord été trouvées chez les mammifères.
Cdc25 est directement phosphorylé par Chk1. Autour de la Ser216, on trouve des motifs de la protéine
14-3-3σ qui co-précipite avec Cdc25. Même si il y a une mutation de la Serine, l’activité phosphorylase
est présente. Donc la forme phosphorylée est inactive (?).
La régulation de cycle chez les levures : le passage du START chez Saccaromyces cerevisae.
Clonage de Cdc28, mutant START chez Saccaromyces cerevisae. (= Cdc2 chez Saccaromyces
pombe).
Voir techniques des banques génomiques du TD3)
Le mutant Cdc254 est bloqués au START.
Est-ce que cette suppression était due au plasmide ?
Cf. TD3. A-t-on cloné le gène Cdc28 ou un suppresseur de Cdc284.
On force la recombinaison homologue du plasmide dans le chromosome. Le marqueur Leu2 va se
retrouver aussi dans le chromosome. On passe alors non plus dans un vecteur de type navette mais
dans un vecteur de type non-réplicatif. On introduit une coupure dans le gène dans le vecteur ce qui
force la combinaison. On ajoute le plasmide dans le chromosome. Avant, la cellule était Leu2Δ, mais
désormais présente le gène Leu2 qui était dans le plasmide. On va pouvoir trouver ce gène Leu2 et voir
si il est localisé dans Cdc28 ou ailleurs.
On peut aussi voir ou ca s’est intégrer car on supprime le phénomène de multicopie est donc on efface
la thermo résistance.
Rappel : obtention de mutants nuls.
On a ici un appariement linéaire avec perte du gène fonctionnel.
Procédure générale d'analyse.
Séquençage du gène cloné => séquence de la protéine correspondante => Comparaisons avec d'autres
séquences connues.
Clonage du gène dans un vecteur bactérien si possible étiqueté.

On insère une petite séquence juste avant le coton stop, et qui sera très immunogène (il ne faut pas
qu'il modifie trop la structure de la protéine). C'est le système de marquage.
Analyse de suppresseurs multicopies spécifiques de l’allèle Cdc28-4
On remarque que les deux plasmides sécrètent des protéines fortes ressemblant aux cyclines : Cln1 et
Cln2. Diapositive.
Quel est le phénotype pour un mutant Cln1 et Cln2 ?
On fabrique ses mutants. On casse les gènes par des marqueurs de sélection que l’on va remplacée dans
le chromosome de la levure. On part de diploïdes au cas où remplacement chez un haploïde soit létal. Se
diploïde est délété pour trois marqueurs : Ura3 Δ/Δ, Leu2 Δ/Δ, Trp1 Δ/Δ.
On remplace donc le gène sauvage Cln1 par Cln1::Trp1 et Cln2 par Cln2::Leu2
On regarde la méiose et on regarde les spores. On récupère uniquement les cellules qui sont mutantes
pour Cln1, Cln2, et pour le double mutant. Si les cellules présentent ces gènes Leu et Trp, cela veut dire
qu'elles ont aussi Cln1- et Cln2-.
Si on fait ses mutants GDF (gain de fonctions).
Quand Cln1 ou Cln2 est surproduit, les cellules sont de petites tailles. Les mutations PDF et GDF n'ont
pas des phénotypes très marqués.
Il existe une troisième cycline qui a été
identifiée de manière indépendante de ces manipulations.
Démarche :
Mutagénèse de cellules haploïdes (car on veut des mutants récessifs) : synchronisation des cellules au
point START => séparation des cellules sur gradient de saccharose et récupération des cellules de petites
tailles.
Ils ont trouvé un mutant Whi avec une taille de 50 % du type sauvage.
WHI/whi : petites tailles avec une mutation dominante. On s'aperçoit que le gène codant contient
plusieurs phases de lecture.
On coupe la région chromosomique par des enzymes de restrictions, puis on clone dans un vecteur
réplicatif en utilisant un marqueur Ura3. On transfecte alors les cellules sauvages.
On surproduit les gènes. Un de ces gènes confère une petite taille à la cellule : mêmes phénotypes que
whi. La surproduction de la protéine sauvage a le même phénotype que le mutant dominant.
On séquence alors le gène : 1740 bases pour 580 acides aminés. La séquence ressemble à celle des
cyclines 1 et cyclines 2. La partie C-terminale de la protéine est très importante dans la dégradation de
la protéine ce qui explique la protéine mutée tronquée s'accumule et donne un mutant gain de
fonctions.
Construction d'un prix triple mutant Cln1, Cl2, Cln3.
Le phénotype est létal. On veut maintenant connaître les phénotypes finaux, leurs points d’exécutions.
On fait des triples mutants conditionnels. On part du double mutant Trp Leu (Cln1Cln2) haploïde que
l'on transfecte par le plasmide ayant le gène Cln1 sous contrôle du promoteur Gal1.
Cln1 ne sera exprimé qu'en présence de galactose. On travaille maintenant sur le milieu avec du
galactose et on remplace Cln3 par Cln3 ::Ura3.

Puis ensuite sur glucose : les cellules non plus de bourgeons et ont une seule molécule d'ADN. En
contact avec une cellule de sexe complémentaire, elles peuvent fusionner. Le blocage et le point
exécution sont au point START. Il doit y avoir d'autres cyclines pour le reste du cycle cellulaire.
On va rechercher les autres types de cyclines. Mises en évidences des cyclines B.
Il existe des mutants Cdc28 atypiques qui ne sont pas bloqués au START met à l'entrée de mitose. C'est
le mutant Cdc28-1N. On retransfecte avec des levures Leu2Δ. Par les mêmes manipulations que
précédemment on trouve des suppresseurs de Cdc28-1N et on s'assure qu'il ne s'agit pas de mutants
Cdc28-4. On distingue quatre groupes de plasmides qui suppriment Cdc28-1N mais pas Cdc28-4.
Analyse des mutants nuls.
On a encore l'impression d'une redondance.
Fluctuations des différentes cyclines au cours du cycle.
Les cyclines 3 et 4 sont capables de se substituer aux 5 et 6 lorsque ces dernières ne sont pas là. Il faut
une forte concentration de 3 et 4 pour entrer en phase S. Les CLN sont présentes mais sont incapables
de faire passer le START. Les CycB5-6 sont nécessaires pour passer en phase S. si on a un mutant B5 B6,
il faut atteindre les B3 B4 pour entrer en phase S.
Analyse des redondances des cyclines B.
=> la morphogénèse dépend des cyclines N. La rentrée en phase S dépend des cyclines B.
À 36 degrés : après transfert sur galactose, on fait exprimer Cln5 : les cellules redémarrent mais ne
pourraient pas rentrer en mitose. Cln 5 est suffisante pour assurer la rentrée et le maintien de la phase S
et ne permet pas de rentrer en mitose.
À 23 ° : sur glucose, Clb2 est exprimé mais pas Clb5 : pas de rentrer en phase S. mais émergence du
bourgeon. Clb2 est incapable de faire rentrer en phase S. on montre que si on fait exprimer Clb2 à un
autre moment du cycle (phase de mitose par exemple), on est incapable de faire rentrer en phase S.
Pour faire rentrer à morphogène, il faut soit Cln1 ou 2 ou3.
Pour faire rentrer en START : il faut soit Clb5 ou 6.
Pour faire rentrer en phase S : il faut soit Clb3 ou 4.
Finalement seulement trois d'entre elles sont
essentielles pour le cycle : il existe une énorme redondance.
Chez Saccaromyces pombe.
Cdc13 a été identifié comme un mutant thermosensible. (Qui s'arrête en phase G2/M) : indispensable
pour entrer en phase de mitose.
Cig1 : rôle équivalent du START
Cig2 : active à la rentrée en S.
Sauf que l'on peut faire enlever Cig1 et Cig2 et il ne se passe rien du tout. Une seule kinase (cdc2) et une
seule cycline semblent être suffisantes.
Quand on prend des cellules ΔCig1 et ΔCig2 : la cinétique d'activité kinase est différente. La courbe
représente le complexe Cdc2Cdc13 alors que dans le grave supérieur, il y avait les complexes
Cdc2Cdc13, Cdc2cig1, et cdc2cig2.
Il existe une activité seuil pour entrer en phase S et aussi en phase M. il s'agit d'un problème quantitatif
avec des notions d'activités. Il existe des substrats à basse et à haute affinité.
Les substrats en G1/S sont à haute affinité.

Les substrats en M sont à faible affinité.
Qu'est-ce qui empêche de rentrer en phase S lorsque l'on a une forte activité kinase ?
Le fonctionnement de la machinerie de la phase S empêche l'entrée en phase M tant que S n'est pas fini
: c'est le rôle du checkpoint avec le contrôle inactif decdc25 et le maintien actif de Wee1. (Cdc25 est un
activateur de CDC2 alors queWee1 est un inactivateur de cdc2)
1
/
4
100%