Physique Chimie 18 Les molécules : Formules et groupes

Physique Chimie 18 Les molécules : Formules et groupes caractéristiques
I. Matériaux et molécules :
1. Diversité des matériaux :
Dans le milieu sportif, un grand nombre de matériaux avec des propriétés particulières sont utilisés.
Exemples :
- Fibres de carbone, de verre…
- Les alliages,
- Le bois,
- Les polymères (combinaisons et vêtements ; caoutchouc ; matières plastiques des perches, raquettes
… )
2. Définition d’une molécule :
Une molécule est un édifice chimique électriquement neutre constituée d’atomes reliés entre eux par des
liaisons.
Dans une molécule, chaque atome forme autant de liaison qu’il lui manque d’électrons pour respecter la
règle de l’octet ou du duet.
Une liaison entre deux atomes est représentée par un trait.
Un atome peut former plusieurs liaisons avec un autre atome. On obtient alors une liaison multiple (double
ou triple liaison).
Exemples :
- La molécule de chlorure d’hydrogène HCl.
H (Z = 1) (K)1 H Cl
Cl (Z = 17) (K)2(L)8(M)7
- La molécule de dioxygène O2.
O (Z =8) (K)2(L)6 O O
- La molécule de diazote N2.
N (Z = 7) (K)2(L)5 N N
3. Modélisation d’une molécule :
Une molécule peut être modélisée par « un modèle moléculaire » qui rend compte de la structure et de la
géométrie de la molécule.
Pour réaliser cette modélisation on peut choisir un modèle éclaté ou un modèle compact.
4. Structure d’une molécule :
On appelle structure d’une molécule l’enchaînement des atomes qui la constituent.
Il existe des molécules linéaires, ramifiées, cycliques.

Exemples :
II. Formules d’une molécule :
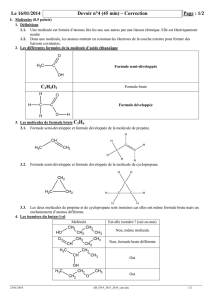
1. Formule brute :
La formule brute d’une molécule indique la nature et le nombre de chaque atome qui la constitue.
Exemple :
C6H14 : 6 atomes de carbone et 14 atomes d’hydrogène.
La formule brute ne renseigne pas sur la structure de la molécule.
2. Formule développée :
Dans une formule développée, les atomes sont représentés par leur symbole et les liaisons sont
représentées par des traits.
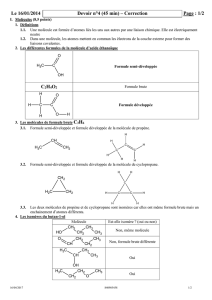
3. Formule semi-développée :
Dans une formule semi-développée, les liaisons avec les atomes d’hydrogène ne sont plus représentées.
On indique en indice le nombre d’atomes d’hydrogène liés à un atome de carbone.
Molécule A
Molécule B
Molécule C
Molécule cyclique
Molécule linéaire
Molécule ramifiée
composé
Formule
brute
Formule développée
Formule semi-développée
Molécule A
C6H12
Molécule B
C6H14
ou
Molécule C
C6H14
ou
CH3
CH2
CH2
CH2
CH2
CH3
H
H
H
H
H
H
H
H
H
H
C
C
C
C
C
C
H
H
CH2
CH2
CH2
CH2
CH2
CH2
CH3
CH2
CH
CH3
CH2
CH3
CH3
(CH2)4
CH3
H
C
C
C
C
C
C
H
H
H
H
H
H
H
H
H
H
H
H
H

III. Groupes caractéristiques :
Un groupe caractéristique est une partie d’une molécule qui lui donne des propriétés chimiques et physiques
particulières.
C’est un groupe d’atomes reliés entre eux dont au moins un n’est pas un atome de carbone.
Exemples : CH3-CH2-OH
CH3-CH2-COOH
CH3-CH2-CH2-CH2-NH2
IV. Isomères :
On appelle « isomères » des molécules qui ont la même formule brute mais dont les atomes sont liés
différemment entre eux.
Des isomères ont des propriétés chimiques et physiques différentes.
Exemples :
Voir les molécules B et C.
C2H6O H3C-O-CH3 et CH3-CH2-OH
p 286 : 5 ; 6 ; 8 ; 9 ; 11 ; 14 ; 20 ; 21 ; 23.
CH3
CH2
CH(CH3)
CH2
CH3
1
/
3
100%