Devoir 2

Devoir n°2
20/01/2017 Terminale
SB
Physique Chimie
I. Chimie Synthèse et dosage du paracétamol (8 points)
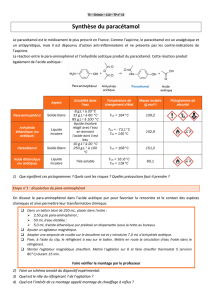
1. Synthèse du paracétamol
Le paracétamol ou para-acétyl-amino-phénol est un antipyrétique, entre autres,
synthétisé pour la première fois par Harmon Northrop Morse en 1878. Jusque-là les
antipyrétiques étaient obtenus à partir de préparations réalisées avec des écorces de
Cinchona ou de Saule. Le paracétamol découvert par Morse ne fut commercialisé
qu’une cinquantaine d’années plus tard sous le nom de paracétamol.
Le paracétamol est un médicament qui se rapproche de l’aspirine par ses propriétés analgésiques et antipyrétiques.
Il est dépourvu d’action anti-inflammatoire, mais ne présente pas les contre-indications de l’aspirine
On l’obtient par réaction entre le para-aminophénol et l’anhydride éthanoïque en milieu aqueux.
La synthèse du paracétamol peut être réalisée au laboratoire à partir du para-aminophénol et de l’anhydride éthanoïque.
L’équation de la réaction de la synthèse est la suivante :
Cette réaction se fait en plusieurs étapes. L’équation ci-dessous est celle de la première étape :
Données :
Masse molaire moléculaire du paracétamol : 151,2 g.mol-1
Électronégativité (échelle de Pauling) de quelques éléments chimiques :
Numéro atomique
Nom
Symbole
Électronégativité (Pauling)
1
Hydrogène
H
2,20
6
Carbone
C
2,55
7
Azote
N
3,04
8
Oxygène
O
3,44
1.1. Ecrire la formule semi-développée de l’anhydride éthanoïque.
1.2. Réécrire la formule topologique du paracétamol. Entourer et nommer les groupes caractéristiques présents dans la
molécule de paracétamol.
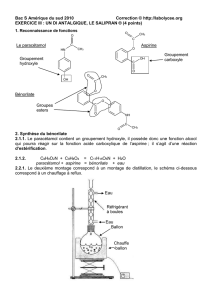
2. Mécanisme réactionnel.
2.1. À quelle catégorie (addition, élimination ou substitution) appartient la réaction de l’étape n°1.
2.2. Identifier, en justifiant votre réponse, les deux sites donneurs de doublets d’électrons présents sur la molécule de
para-aminophénol.
2.3. Représenter sur le sujet à rendre avec la copie, la (ou les) flèche(s) courbe(s) qui rend(ent) compte de l’obtention
de l’intermédiaire réactionnel A de la première étape..

3. Propriétés acido-basiques du paracétamol : Le paracétamol et l’eau
Cette partie a pour but d’étudier les propriétés acido-basiques du paracétamol, noté AH, en solution aqueuse. Sa base
conjuguée, dont la formule semi-développée est précisée ci-contre, sera notée A-.
La réaction entre le paracétamol AH et l’eau modélise la transformation étudiée. On
dissout un comprimé effervescent de Doliprane 500 dans un verre d’eau de
volume V=100 mL d’eau. La masse correspondante de paracétamol dissoute est m =
500 mg. On note S la solution ainsi préparée. À
25 °C, la mesure du pH de la solution S à l’équilibre donne 5,5.
3.1. Le paracétamol AH réagit avec l’eau. Écrire l’équation de la réaction modélisant cette réaction.
3.2. Déterminer, à l’équilibre ou état final, la concentration [H3O+]final en ions oxonium dans la solution S.
3.3. Déterminer l’avancement xmax de la réaction en supposant la réaction totale.
3.4. Déterminer l’avancement final xfinal de la réaction.
3.5. Démontrer que la concentration du paracétamol AH a pour valeur à l’état final :
[AH]final
c = 3,3 10-2 mol.L-1.
Données : une solution est électriquement neutre ; [HO-(aq)] négligeable devant [H3O+(aq) ] .
3.6. Que peut-on dire de la réaction entre le paracétamol et l’eau. Justifier.
4. Propriétés acido-basiques du paracétamol : Espèce prédominante dans l’estomac
4.1. À partir de l’équation de la réaction du paracétamol avec l’eau écrite au 3.1, donner l’expression de la constante
d’acidité KA du paracétamol.
4.2. Démonter que le pH et le pKA sont reliés par la relation pKA = 2 × pH + log(c), avec c la concentration l’espèce AH
à l’état initial.
On rappelle que log(a×b)= log(a)+log(b) et que log(
Error!
) =- log(x).
4.3. En utilisant les résultats des questions 3.5 et 4.2, calculer le pKA lorsque le pH (à l’équilibre) vaut 5,5.
4.4. Le pH de l’estomac humain varie entre 1,5 (pendant la nuit) et 5,0 (en début de digestion).
Pour chacune de ces deux valeurs du pH, quelle est l’espèce, AH ou A-, qui prédomine dans l’estomac après la
prise d’un comprimé de 500 mg ? Justifier.
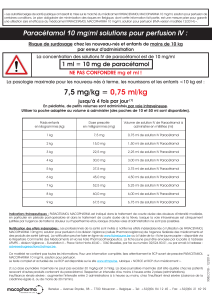
5. Dosage du paracétamol
Une méthode pour doser le paracétamol consiste en une hydrolyse du paracétamol, suivie d’un dosage d’oxydoréduction du
produit de l’hydrolyse, le para-aminophénol par les ions Ce4+. Les quantités de matière de para-aminophénol et de paracétamol
sont égales. Lors de la réaction, le para-aminophénol est susceptible d’être oxydé en para-benzoquinone C6H4O2 en présence
d’ions Ce4+.
L’oxydation du para-aminophénol NH2-C6H4-OH en para-benzoquinone C6H4O2 produit également des ions ammonium NH4+.
L’équation support du dosage est :
NH2-C6H4-OH +H2O+ 2 Ce4+ C6H4O2 + NH4++ 2 Ce3+ +H+(aq) .
On procède au dosage du paracétamol d’un comprimé de Doliprane® 500.
Après hydrolyse la solution totale est de 100 mL. On prélève 10,0 mL de cette solution qu’on dose avec une solution d’ions
Ce4+ (sulfate d’ammonium et de cérium) de concentration C1 = 0,050 mol.L-1 jusqu’au changement de coloration de
l’indicateur coloré d’oxydoréduction. Le volume VE à l’équivalence est de 13,1 mL.
5.1. Définir par une phrase l’équivalence.
5.2. Quelle est la relation entre les quantités de matière des ions Ce4+ et le paracétamol à l’équivalence.
5.3. Calculer la concentration molaire C en paracétamol.
5.4. Déterminer la masse m de paracétamol contenu dans les 100mL.
Rappel : les quantités de matière de para-aminophénol et de paracétamol sont égales
5.5. Conclure quant à la signification du terme Doliprane® 500.
NO-
CH3
O
H

Physique 1 Catch and shoot » et « buzzer beater » ( 7 points)
« Les personnages et les situations de ce récit étant purement fictifs, toute ressemblance avec des personnes ou des
situations existantes ou ayant existé ne saurait être que fortuite. »
Aux Etats-Unis, lors d’un match de basket entre l’équipe des éperons et celle des jazzmen, le score est de 98 à 100 pour
les jazzmen. Il reste 1,30 s avant la fin du match.
Le coach demande un temps mort (pour garder en vie son équipe). Il
propose le système ci-contre.
Il désigne non sans mal Bobo pour shooter à 3 points dans le corner (à
l’extrémité des flèches du schéma ci-contre) à 6,51 m du centre du panier.
La passe sera faite par le petit Tony.
Hypothèses simplificatrices proposées par Greg lors du temps mort :
Les frottements avec l’air seront négligés
La poussée d’Archimède sera négligée.
Seul sera étudié le mouvement du centre de gravité G du ballon.
Le mouvement du centre de gravité G se fera dans un plan.
Le champ de pesanteur est constant et égal à g = 9,80 m.s-2.
On supposera que le ballon parte à la même hauteur que le cercle soit h = 3,05 m.
L’effet Magnus du à la rotation du ballon sur lui-même sera négligeable.
Greg demande à Tony de calculer la trajectoire pour que le shoot soit réussi par Bobo.
Tony connaissant par cœur son cours de physique (quel incroyable talent !) donne les indications suivantes.
Le ballon doit partir à une vitesse initiale v0 = 9,00 m.s-1 avec un angle = 26° par rapport à l’horizontale.
L’origine O des axes est prise à l’endroit où la balle quitte la main de Bobo. Le chronomètre ne démarre qu’au moment où
Bobo prend le ballon pour shooter (d’où l’expression « catch and shoot »).
L’angle entre le vecteur vitesse
Error!
et l’axe Ox est noté .
Le schéma de la situation est le suivant : l’échelle n’est pas respectée.
O
y
x
6,51 m
Error!
diamètre du
cercle : 45 cm

Vérification des calculs de Tony
1. Force(s) exercées sur le ballon
1.1. Préciser le référentiel à utiliser ainsi que le système.
1.2. En utilisant les hypothèses simplificatrices, quelle(s) est (sont) le(s) force(s) qui s’applique(nt) sur le ballon ?
2. Equation de la trajectoire
Les conditions initiales du mouvement sont à t = 0 ;
Error!
(t = 0) =
Error!
et pour x(t = 0) = 0, y(t = 0) = 0
2.1. Rappeler à Tony l’énoncé de la deuxième loi de Newton.
2.2. En appliquant la deuxième loi de Newton, démontrer que les équations horaires du mouvement de G s’écrivent : le détail
du raisonnement est indispensable.
Error!
Error!
2.3. Montrer que l’équation de la trajectoire peut se mettre sous la forme y(x) = -
Error!
Error!
x² + tan() x.
2.4. En utilisant les données, trouver une expression numérique de la trajectoire y(x).
2.5. Tracer sur le sujet l’allure de la représentation graphique de la trajectoire y(x).
3. Buzzer beater ?
3.1. A partir de l’expression générale de y(x), démontrer que la portée du ballon, définie par l’abscisse xP tel que y(xP) = 0,
peut se mettre sous la forme xP =
g)2sin(v2
0
. Donnée : 2 sin() cos() = sin(2).
3.2. Le panier est-il marqué ?
3.3. Quelle est la durée t du shoot ? Le chronomètre affichera-t-il 0,00 s quand le ballon rentre dans le panier.
On supposera que Bobo met 0,50 s entre la réception du ballon et le départ du ballon.
4. Ce que n’avait pas prévu Tony … et Greg
Un joueur des jazzmen, Ruda Gobert, se détend pour atteindre une hauteur H = 3,75 m (du bout des doigts) par rapport au sol.
Ruda est situé à 2,0 m de Bobo au moment du départ de la balle.
4.1. Discuter sur l’éventualité du contre.
4.2. Bobo, voyant arriver Ruda, décide de changer un paramètre de son shoot pour
éviter le contre.
Quel paramètre du shoot peut-il « facilement » changer ? Quelle sera la nouvelle
valeur de ce paramètre ?
4.3. Quelle est la durée t’ du shoot ? L’arbitre Malo va-t-il accorder le panier ?
On suppose toujours que Bobo met 0,50 s entre la réception du ballon et le départ
du ballon.

Figure 2. Vitesse moyenne du sang dans différents
vaisseaux sanguins. ©2011 Pearson
Physique 2 – de l’effet Doppler à ses applications (6 points)
Christian Doppler, savant autrichien, propose en 1842 une explication de la
modification de la fréquence du son perçu par un observateur immobile
lorsque la source sonore est en mouvement. Buys-Ballot, scientifique
hollandais, vérifie expérimentalement la théorie de Doppler en 1845, en
enregistrant le décalage en fréquence d’un son provenant d’un train en
mouvement et perçu par un observateur immobile.
On se propose de présenter l’effet Doppler puis de l’illustrer au travers de
deux applications.
1. Mouvement relatif d’une source sonore et d’un détecteur
Nous nous intéressons dans un premier temps au changement de fréquence associé au mouvement relatif d’une source sonore S
et d’un détecteur placé au point M (figure 1). Le référentiel d’étude est le référentiel terrestre dans lequel le détecteur est
immobile. Une source S émet des « bips » sonores à intervalles de temps réguliers dont la période d’émission est notée T0. Le
signal sonore se propage à la célérité vson par rapport au référentiel terrestre.
Figure 1. Schéma représentant une source sonore immobile (cas A), puis en mouvement (cas B).
1.1. Cas A : la source S est immobile en x = 0 et le détecteur M, situé à la distance d, perçoit chaque bip sonore
avec un retard lié à la durée de propagation du signal.
1.1.1. Définir par une phrase, en utilisant l’expression « bips sonores», la fréquence f0 de ce signal périodique.
1.1.2. Comparer la période temporelle T des bips sonores perçus par le détecteur à la période d’émission T0.
1.2. Cas B : la source S, initialement en x = 0, se déplace à une vitesse constante vs suivant l’axe Ox en direction du
détecteur immobile. La vitesse vs est inférieure à la célérité vson. On suppose que la source reste à gauche du
détecteur.
Le détecteur perçoit alors les différents bips séparés d’une durée
0
'1
S
son
v
TT v
Indiquer si la fréquence f ’ des bips perçus par le détecteur est inférieure ou supérieure à la fréquence f0 avec
laquelle les bips sont émis par la source S. Justifier.
2. La vélocimétrie Doppler en médecine
La médecine fait appel à l’effet Doppler pour mesurer la vitesse
d’écoulement du sang dans les vaisseaux sanguins (figure 2).
Un émetteur produit des ondes ultrasonores qui traversent la
paroi d’un vaisseau sanguin. Pour simplifier, on suppose que
lorsque le faisceau ultrasonore traverse des tissus biologiques, il
rencontre :
- des cibles fixes sur lesquelles il se réfléchit sans modification
de la fréquence ;
- des cibles mobiles, comme les globules rouges du sang, sur
lesquelles il se réfléchit avec une modification de la fréquence
ultrasonore par effet Doppler (figure 3).
Christian Doppler
(1803- 1853)
Christoph Buys-Ballot
(1817-1890)
 6
6
1
/
6
100%