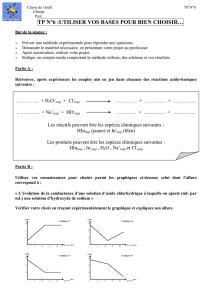
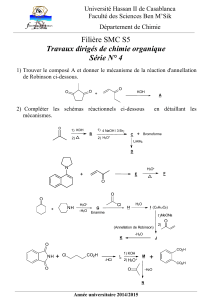
réactions acido-basiques.

C. Guibal – Bellevue 1ère S Réactions acido-basiques page 1 /2
REACTIONS ACIDO-BASIQUES
Un citron a un goût acide. Cette acidité est due à la présence d'ions oxonium H3O + ou H + (aq).
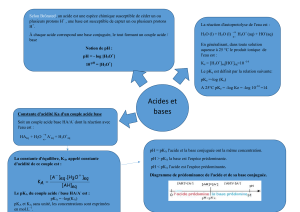
1- DEFINITION d’un ACIDE, d’une BASE, d’un COUPLE ACIDE / BASE
1.1 Couple acide / base (théorie de Brönsted, 1923)
Un acide est une espèce chimique pouvant céder, au moins, un proton H +.
Une base est une espèce chimique pouvant capter, au moins, un proton H +.
Un couple acide / base est constitué d’un acide A et d’une base B conjugués, reliés
par la demi-équation protonique : acide = base + H +
1-2 Expériences : Action d'un acide ou d'une base sur un indicateur coloré
- Rappelons que le pH caractérise le caractère acide, neutre ou basique d'une solution aqueuse.
A 25 °C, une solution aqueuse est acide si pH < 7, neutre si pH = 7, basique si pH > 7 :
- Un indicateur coloré est constitué par un couple acide / base HIn / In - dont les espèces
conjuguées ont des teintes différentes : La couleur observée lorsqu’on met quelques gouttes d’indicateur
coloré dans une solution dépend du pH de cette solution. Par exemple, pour le bleu de bromothymol, la
forme acide est jaune et la forme basique est bleue :
La zone de virage du bleu de bromothymol est comprise entre 6,0 et 7,6.
- En présence d'acide chlorhydrique (H3O + + Cl -) la réaction suivante a lieu (l'ion chlorure est
spectateur) : H3O + + In - H2O + HIn (HIn donne la couleur jaune au mélange).
- En présence d'hydroxyde de sodium Na+ + HO - la réaction suivante a lieu (l'ion sodium est
spectateur) : HO - + HIn H2O + In – (In - donne la couleur bleue au mélange)
Remarque : En mélangeant plusieurs indicateurs colorés, ou arrive à fabriquer du papier pH dont la
couleur évolue progressivement lorsque le pH passe de la valeur 1 à 13. Mais c'est un pH-
mètre, convenablement étalonné, qui donne la meilleure valeur du pH d'une solution.
2- L'EAU est un COMPOSE AMPHOTERE
L'eau se comporte parfois comme un acide, parfois comme une base.
- L'eau H2O est l'acide du couple acide / base H2O / HO - :
- L'eau H2O est la base du couple acide / base H3O + / H2O :
On dit que l'eau est un composé amphotère ou que l'eau est un ampholyte.

C. Guibal – Bellevue 1ère S Réactions acido-basiques page 2 /2
3- Conclusion : les REACTIONS acido-basiques : transfert d’un proton H+
3-1 Ecriture d'une réaction acido-basique
Toute réaction acido-basique fait intervenir l'acide d'un couple acide 1 / base 1 qui donne
un proton (ion H +) à la base d'un autre couple acide 2 / base 2 :
acide 1 = base 1 + H +
base 2 + H + = acide 2 ( Le signe « = » exprime un bilan de matière et de charge)
L'équation-bilan de toute réaction acido-basique s'écrit donc :
acide 1 + base 2 base 1 + acide 2
La flèche simple indique que la réaction est
supposée totale pour le réactif limitant ou pour les
deux réactifs s'ils sont pris dans des proportions
stœchiométriques.
L'année prochaine nous classerons les acides (et les
bases) suivant leur force et nous verrons que
certaines réactions sont limitées, voire impossibles.
Donnons, en complément de programme, l'échelle
classant les couples acide / base. La définition du pKa
d'un couple acide / base ne sera donnée qu'en classe
terminale.
3-2 Formules chimiques d'acides et de bases usuels
Chlorure d'hydrogène : A l'état pur, c'est un gaz formé de molécules de formule HCl.
En solution aqueuse (acide chlorhydrique) sa formule est (H3O + + Cl - (aq)) ou (H +(aq) + Cl - (aq)).
L'ion oxonium H3O + est l'acide conjugué de la base H2O.
Ce serait donc une erreur d'écrire la solution aqueuse d'acide chlorhydrique sous la forme HCl.
Acide nitrique : A l'état pur, c'est un liquide formé de molécules HNO3.
En solution aqueuse, sa formule est : ( H3O + + NO3 - (aq) ) ou ( H + (aq) + NO3 - (aq) ).
Il serait faux d'écrire la solution aqueuse d'acide nitrique sous la forme HNO3.
Acide sulfurique : A l'état pur, c'est un liquide formé de molécules H2SO4.
En solution aqueuse, sa formule est : ( 2 H3O + + SO4 2 - (aq) ) ou ( 2 H + (aq) + SO4 2 - (aq) ).
L'ion oxonium H3O + est l'acide conjugué de la base H2O.
Ce serait donc une erreur d'écrire la solution aqueuse d'acide sulfurique sous la forme H2SO4.
Hydroxyde de sodium (soude) : A l'état pur, c'est un solide ionique de formule NaOH (s).
En solution aqueuse, sa formule est : ( Na + (aq) + HO - (aq) ).
L'ion hydroxyde HO - est la base conjuguée de l'acide H2O.
Hydroxyde de potassium (potasse) :A l'état pur, c'est un solide ionique de formule KOH (s).
En solution aqueuse, sa formule est : ( K + (aq) + HO - (aq) ).
L'ion hydroxyde HO - est la base conjuguée de l'acide H2O.
Ammoniac : A l'état pur, c'est un gaz de formule NH3 (g).
Sa solution aqueuse (ammoniaque) contient essentiellement des molécules NH3 (l). Néanmoins,
le milieu est basique car une partie des molécules NH3 ont réagi avec l'eau H2O en donnant les
espèces conjuguées NH4 + (aq) et HO - (aq). La présence d'ions HO - rend le pH basique (pH > 7).
1
/
2
100%