Réactions acido-basiques

1/4
DS5 TS2 31 janvier 2008
RENDRE LE SUJET AVEC LA COPIE
Exercice n°1 (10 points) RÉACTIONS ACIDO-BASIQUES
1. Identification d'un indicateur coloré.
On dispose d'un flacon d'indicateur coloré avec comme seule indication sa concentration molaire :
C0 = 2,90.10-4 mol.L-1
On mesure son pH: 4,18.
Le couple acide/base présent dans cet indicateur coloré sera noté HInd/Ind–.
La solution d'indicateur coloré a été préparée à partir de la forme acide de l'indicateur : HInd.
L'équation de la réaction entre HInd et l'eau est : HInd + H2O = Ind– + H3O+
1.1 Calculer la concentration molaire en ions oxonium, [H3O+].
1.2 Faire un tableau d’avancement puis déterminer le taux d'avancement final de la réaction de l'acide HInd
avec l'eau. Cet acide est-il totalement dissocié dans l'eau ? Justifier votre réponse.
1.3 Donner l'expression littérale de la constante d'acidité KA de la réaction de l'acide HInd sur l'eau.
1.4 Calculer le KA de ce couple et en déduire le pKA.
1.5 Identifier l'indicateur à l'aide des données du tableau suivant :
Indicateur
Couleur acide
Zone de virage
Couleur
basique
pKA
Hélianthine
Jaune orangé
3,1 – 4,4
rouge
3,7
Vert de
Bromocrésol
jaune
3,8 – 5,4
bleu
4,7
Bleu de
Bromothymol
jaune
6,0 – 7,6
bleu
7,0
Phénolphtaléine
incolore
8,2 – 10,0
fuschia
9,4
2. Dosage d'une solution d'acide chlorhydrique concentrée.
Dans le laboratoire d'un lycée, on dispose d'un flacon d'une solution d'acide chlorhydrique concentrée où est
notée sur l'étiquette l'indication suivante : 33% minimum en masse d'acide chlorhydrique.
On appellera cette solution S0.
On veut connaître la concentration molaire c0 de cette solution.
Première étape :
On dilue 1000 fois la solution S0 . On obtient alors une solution S1 de concentration C1.
Deuxième étape :
On prélève précisément un volume V1=100,0 mL de solution S1.
On dose par conductimétrie la solution S1 par une solution titrante d'hydroxyde de sodium de
concentration CB= 1,00.10-1 mol.L-1. La représentation graphique de la conductance de la solution
en fonction du volume V de solution titrante versé est donnée dans l'annexe 2, document n°1.
2.1 On ajoute la solution d'hydroxyde de sodium pour doser la solution S1. Écrire l'équation de la réaction
acido-basique.
2.2 Déterminer graphiquement, sur le document n°1 de l'annexe 2, le volume versé VE à l'équivalence.
2.3 A l'équivalence, écrire la relation existant entre C1, CB, VE et V1 en la justifiant et calculer la concentration
molaire C1 de la solution d'acide chlorhydrique diluée S1.
2.4 En déduire la concentration molaire C0 de la solution d'acide chlorhydrique concentrée S0.
2.5 Calculer la masse m0 d'acide chlorhydrique HCl dissous dans un litre de solution.
On donne la masse molaire de l'acide chlorhydrique M(HCl) = 36,5 g.mol-1.
La solution S0 a une masse volumique 0 = 1160 g.L-1.
Le pourcentage massique de la solution S0 représente la masse d'acide chlorhydrique dissous dans 100 g de
solution.
2.6 Quelle est la masse m d'un litre de solution S0 ?
2.7 Calculer le pourcentage massique de la solution S0. L'indication de l'étiquette du flacon de solution d'acide
chlorhydrique concentrée est-elle correcte ?
3. Une simulation du dosage par suivi pH-métrique de la solution S1 est donnée dans l'annexe 2, document n°2.
3.1 Faire le schéma annoté du montage de suivi pHmétrique.

2/4
3.2 Déterminer graphiquement le point équivalent E en expliquant votre méthode. En déduire VE.
3.3 Sur le document n°2, indiquer la zone de virage de l'indicateur identifié à la question 1.4. En utilisant cet
indicateur pour le dosage de la solution S1, décrire le changement de couleur observé.
3.4 Dans la liste donnée à la question 1.3, y-a-t-il un indicateur coloré mieux adapté pour repérer
l'équivalence du dosage ? Justifiez votre réponse.
Attention : L’annexe 2 est à rendre avec votre copie.
Annexe 2 : À rendre avec la copie
Document n°1 : Dosage de la solution diluée d'acide chlorhydrique S1 par conductimétrie
Document n°2 : Simulation du dosage de la solution diluée d'aide chlorhydrique S1 par pH-métrie
Conductance (µS)

3/4
EXERCICE 2 : LE PIEGE PHOTO –10 POINTS
Cet exercice étudie le principe de fonctionnement d'un piège photo réalisé par un ornithologue afin d'identifier le
prédateur d'une espèce d'oiseaux en voie de disparition.
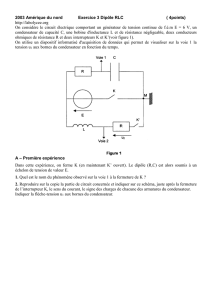
Le circuit de charge (Fig.2), outre le condensateur de capacité C, est constitué d'un conducteur ohmique de résistance R
et d'un générateur idéal de tension de force électromotrice E = 8,0 V.
I – Armement du dispositif
Le dispositif s'arme en plaçant le commutateur en position 1 pendant la durée nécessaire à la charge du condensateur.
Cette opération réalisée, I'œuf est déposé sur le bras du commutateur à bascule qui est ainsi maintenu en position 0.
1. Recopier soigneusement le schéma du circuit de charge du condensateur sur votre copie. Indiquer sur ce schéma le
sens réel du courant lors de la charge du condensateur.
Établir l'équation différentielle vérifiée par la tension uC(t) aux bornes du condensateur lors de sa charge.
Vérifier que cette équation différentielle est de la forme uc(t) +
C
du (t)
dt
= E .
En déduire l'expression de la constante en fonction des paramètres du circuit.
2. Montrer par une analyse dimensionnelle que le constante est homogène à un temps.
3. Déduire de l'équation différentielle la valeur Uc de uC(t) en régime permanent.
4. Montrer que l'expression uC(t) = A.(1 -
t/
e
) est solution de l'équation différentielle à condition que la constante A soit
égale à la valeur E de la force éIectromotrice du générateur.
5. Montrer que pour une durée égale à 5 on peut considérer que la charge du condensateur est totale.
6. Un enregistrement de la tension uC(t) a été réalisé (graphique 1, annexe à rendre avec la copie). Évaluer le plus
précisément possible la valeur de sur cet enregistrement en expliquant la méthode utilisée.
En déduire la durée minimale durant laquelle l'opérateur doit maintenir l'interrupteur en position 1 afin de réaliser la
charge du condensateur.
II - Déclenchement du piège
Lorsque I'œuf est prélevé par le prédateur, le commutateur bascule de la position 0 dans laquelle l'opérateur l'avait placé
après la charge du condensateur, à la position 2.
Un enregistrement de la tension uC(t) aux bornes du condensateur est réalisé lors de l'étude de ce dispositif (graphique
2, annexe à rendre avec la copie ).
1. On admet que la décharge du condensateur dans la bobine de l'électroaimant est apériodique. C'est l'énergie
transférée qui provoque le déplacement du barreau de l'électroaimant.
Le " temps de réaction " du piège peut être caractérisé par la durée notée t1/2 au bout de laquelle la tension du
condensateur est réduite de moitié.
Déterminer cette durée caractéristique en exploitant l'enregistrement (graphique 2, annexe).
2. Afin que le barreau de l'éIectroaimant soit éjecté et percute avec la meilleure efficacité le déclencheur de l'appareil
photo, l'énergie initialement emmagasinée par le condensateur doit être la plus importante possible.
En justifiant vos choix, indiquer, parmi les paramètres ci-dessous, quels sont ceux sur lesquels on peut agir pour atteindre
cet objectif :
- la force électromotrice E du générateur idéal de tension,
- la capacité C du condensateur,
- la résistance R.
III - Détermination de l'inductance L de la bobine qui constitue l'électroaimant
Afin de déterminer l'inductance L de la bobine qui constitue l'électroaimant, on place cette bobine en série avec un
condensateur de capacité C' = 10 nF initialement chargé sous une tension de 6 V et une résistance R' tel que ( R' + r) =
50 , le circuit ainsi constitué est représenté ci-dessous.
Un oeuf de caille posé sur un commutateur à bascule sert d'appât dans un vieux nid (Fig.1).
Lorsque le prédateur prélève l'œuf, le commutateur bascule de la position 0 à la position 2
(Fig.2). Le condensateur du dispositif, initialement chargé, se décharge dans un
électroaimant que l'on peut modéliser par une bobine d'inductance L et de résistance
interne r. L'électroaimant, placé sur l'appareil photo, déclenche alors la prise de vue.

4/4
L'évolution de la tension aux bornes du condensateur a été enregistrée à la
fermeture de l'interrupteur, elle figure sur le graphique 3 de l'annexe.
1. Comment nomme-t-on le régime correspondant à cette évolution de la
tension uC(t) aux bornes du condensateur.
2. Utiliser l'enregistrement pour déterminer I'inductance L de la bobine.
Justifier votre démarche.
EXERCICE 2 : ANNEXE À RENDRE AVEC LA COPIE
Graphique 1 : Évolution de la tension uc aux bornes du condensateur lors de sa charge.
Graphique 2 : Évolution apériodique de la tension uC aux bornes du condensateur lors de sa décharge dans la bobine de l'électroaimant.
Graphique 3 : Évolution de la tension uC aux bornes du condensateur.
C'
R'
L, r

5/4
2003 Afrique Exercice n°3 RÉACTIONS ACIDO-BASIQUES Corrigé
1. Identification d'un indicateur coloré.
1.1.
LmolOH pH /10*6.610 5
3
1.2 =
max
x
xf
Si la transformation est totale HInd est totalement consommé, soit xmax = C0×V
Dans l'état final d'équilibre, xf = [H3O+]éq×V
33
00
éq éq
H O V H O
C V C
5
4
6,6.10
2,90.10
= 23%
< 100%, donc la transformation est limitée, toutes les molécules de la forme acide de l’indicateur coloré ne sont pas dissociées.
1.3.
( ) 3 ( )
()
aq aq
éq éq
Aaq éq
Ind H O
KHInd
1.4.
5
54
2
510*94,1
10*6,610*90,2 10*6.6
A
K
pKA = –log(KA)
pKA = –log(1,9.10–5) = 4,7
1.5 L’indicateur coloré est le vert de bromocrésol
2. Dosage d'une solution d'acide chlorhydrique concentrée.
2.1. L’acide chlorhydrique et la soude sont entièrement dissociés dans l’eau.
H3O+(aq) + HO–(aq) = 2 H2O(l)
2.2. L’équivalence lors d’un dosage conductimétrique correspond au point d’intersection des deux droites (voir figure), soit VE = 11,2
mL
2.3. A l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques, soit
+
HO
3
n
initiale=
HO
n
versée
C1.V1 = CB.VE
C1 =
1
BE
CV
V
C1 =
1
1,00.10 11,2
100,0
= 11,210–3 mol.L-1
2.4. La solution S0 a été diluée 1000 fois C0 = 1000×C1 = 11,2 mol.L-1
2.5. m0 = n0×MHCl = C0×V×MHCl
m0 = 11,2×1×36,5 = 409 g
 6
6
 7
7
 8
8
1
/
8
100%