Chapitre 10

Biochimie
Chapitre 10 – Réplication, transcription et traduction de l’information génétique
- 1 -
Chapitre 10 – Réplication, transcription et traduction de
l’information génétique
I. Introduction
Document
L’ADN est le support de l’IG, elle va être transmise de génération en génération. C’est cette
info qui va permettre la synthèse des protéines.
L’IG portée par l’ADN n’est pas utilisée telle quel, elle va être transposée dans une molécule
d’ARN appelée ARNmessager, puis interprétée pour fabriquer des protéines.
On a donc un premier transfert d’info possible de l’ADN à l’ADN lorsqu’une cellule se
multiplie : la réplication.
Lorsque cette info a besoin d’être utilisée :
- on a un transfert de l’ADN vers l’ARN : la transcription ;
- puis de l’ARN vers les protéines : la traduction.
II. La réplication de l’ADN
Document
L’hérédité génétique est remarquablement conservée génération après génération. Pour cela, il
est nécessaire que l’ADN synthétisé pour une cellule fille soit identique à l’originale. (ex : le
génome humain se réplique 1 million de milliard de fois au cours du développement d’un
individu). Ceci prouve que la réplication doit être totale et identique.
Il faut donc imaginer des systèmes qui vont corriger les erreurs. On considère que chez les
bactéries, il y a une erreur de duplication tous les 1010 NT incorporés.
Etant donné la taille des génomes et la vitesse de la division, la réplication se doit d’être un
mécanisme extrêmement rapide. (ex : E. Coli assemble 2000 NT par seconde).
A. Positionnement du problème
Document
Watson et Crick avaient découvert la structure secondaire de l’ADN en 1953 en utilisant la
technique de diffraction aux rayons X. Pour eux, l’ADN était constitué de 2 chaînes poly-
désoxyribo-nucléotidiques reliées entre elles par des LH sous forme d’une double hélice. Ils
pensaient que les 2 hélices s’appariaient par complémentarité de bases et que la réplication
devait se faire par un mode semi conservatif. Il fallait donc imaginer une séparation des 2
brins et la synthèse de nouveaux brins filles complémentaires des chaînes séparées. Ceci
donnera naissance à 2 nouvelles chaînes poly-nucléotidiques.
B. Vérification expérimentale du postulat de WATSON et CRICK
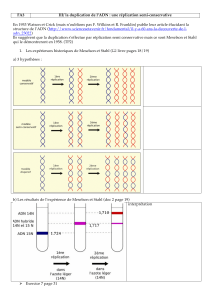
1) Différents mécanismes possibles de réplication de l’ADN
a) réplication conservative de l’ADN lourd
Schéma b) réplication dispersive
Schéma
Dans ce cas on imaginait que les chaînes parentales se fragmentent de place en place. Les
nouveaux brins étant constitués à la fois d’ADN servant de modèle (AN parental) et d’ADN
nouvellement synthétisé. Dans ce cas on dit que les brins obtenus sont des brins hybrides.
c) réplication semi-conservative : postulat de WATSON et CRICK
Pour eux les 2 brins d’ADN d’une double hélice vont se séparer et vont servir de modèle pour
resynthétiser leur brin complémentaire. A la 1ère génération les doubles hélices d’ADN sont
constituées d’un brin parental et d’un brin nouvellement synthétisé
2) Expérience de MESELSON et STAHL (1958)
a) principe expérimental
Il est possible de suivre le devenir de différentes molécules dans une cellule grâce aux
méthodes de traçage aux isotopes. L’ADN qui contient beaucoup d’azote peut être marquée

Biochimie
Chapitre 10 – Réplication, transcription et traduction de l’information génétique
- 2 -
avec l’15N (azote lourd) qui a un proton de plus que l’14N. Ce marquage entraîne l’apparition
de molécules d’ADN qui vont avoir une densité supérieure à celle synthétisée avec du 14N. Il
fallait mettre au point une technique séparative permettant de visualiser ces 2 types d’ADN.
b) les techniques
Les auteurs ont fait pousser une souche d’E. Coli sur un milieu minimum dans lequel la
source d’N est du NH4Cl (chlorure d’ammonium) contenant du 15N. Après de nombreuses
divisions, on considère que toutes les bactéries ont leur composés azotés avec du 15N, en
particulier les AN. La même opération est réalisée avec un lot de bactéries se développant sur
du NH4Cl contenant du 14N.
Après extraction de ces 2 types d’ADN et ultracentrifugation à 100 000 G pendant 48h sur un
gradient de chlorure de césium (CsCl) on constate qu’on est capable de séparer 2 ADN : un
ADN léger qui a une densité de 1,710 et un ADN lourd d’une densité de 1,724.
c) protocole
On utilise une souche d’E. Coli. Elle a un Xme bicaténaire circulaire. On cultive cette souche
pendant plusieurs jours sur du NH4Cl lourd contenant du 15N. A t0 les bactéries ainsi
marquées sont transférées sur un milieu ne contenant que du NH4Cl léger. A chaque
génération on extrait l’ADN et on observe quelle est sa densité.
Doc 3-4
A t0 on obtient que de l’ADN lourd.
A t1, après une division, on obtient un ADN dont la densité sera intermédiaire entre l’ADN
lourd et l’ADN léger. Ceci élimine l’hypothèse de la réplication conservative.
A t2, après 2 divisions de cellules de départ, on observe 2 types d’ADN, de l’ADN léger et de
l’ADN de densité intermédiaire. Ce qui élimine l’hypothèse de la réplication dispersive qui ne
génère qu’un type d’ADN.
On a prouvé que la réplication est semi-conservative.
C. Les mécanismes de la synthèse d’ADN ou réplication
Le déroulement de la réplication a d’abord été étudié chez les proK, en particulier chez E.
Coli. Durant ce mécanisme on distingue 3 étapes : initiation, élongation et terminaison.
1) Initiation
a) Site d’initiation
HERNST a rendu radioactives des cellules d’E. Coli en utilisant de la thymidine tritiée. En
faisant des autoradiographies on est capable de visualiser un point unique où commence la
réplication. Cette origine de réplication (OR) va donner naissance à 2 fourches de réplication.
Chez les proK il faut une 30aine de minutes pour dupliquer l’ADN, c’est pourquoi il y a une
OR. Par contre chez les euK les Xmes étant beaucoup plus longs on visualise plusieurs OR
une à peu près toutes les 40 000 paires de bases. La réplication sera terminée lorsque toutes
ces origines se seront rejointes.
Doc 5-6 b) signal moléculaire
Chez E. Coli, l’OR est un site unique d’une longueur de 245 paires de bases (PB), il contient
des séquences consensus très conservées chez les bactéries. ON observe 9 PB répétées 4 fois
et 13 PB répétées en tandem (l’une après l’autre). Cette zone va être reconnue par une 10aine
de protéines différentes, en particulier par la DnaA.
Doc 7
C’est la DnaA qui va séparer les 2 brins d’ADN au niveau des unités répétitives de 13 PB. Ce
mécanisme nécessite de l’énergie et donc de l’ATP. C’est une hélicase qui va dérouler la
fourche de réplication après action de la DnaA. Pour empêcher que les 2 brins d’ADN ne
s’apparient des protéines particulières SSB (Single Standed DNA Binding Protein) vont venir
se fixer. La progression de l’hélicase va entrainer l’apparition de « nœuds » qui vont être

Biochimie
Chapitre 10 – Réplication, transcription et traduction de l’information génétique
- 3 -
réduits grâce à l’activité d’une topoisomérase qu’on appelle la gyrase. On dit qu’elle sert à
éliminer les super-tours (= les nœuds).
Doc 8
Maintenant que les 2 brins d’ADN sont séparés une amorce d’ARN va être synthétisée par
une primase. Cette amorce fait 10 NT de long. Cette enzyme ne travaille pas seule, c’est un
complexe multiprotéique que l’on appelle primozome qui réalise cette étape.
Doc 9 2) Elongation
a) l’ADN polymérase
C’est en 1955 que KORNBERG a isolé d’E. Coli une ADN polymérase qu’on a nommé ADN
polymérase 1. On a constaté que des bactéries mutantes ne contenant pas cette ADN
polymérase sont quand même capables de se diviser. Il existe donc plusieurs ADN
polymérases. Par contre on a constaté que ces bactéries étaient très sensibles aux UV. On a
imaginé que cette ADN polymérase I était une enzyme de réparation.
Par la suite on a mis en évidence 4 polymérases supplémentaires (II, III, IV, V). C’est l’ADN
polymérase 3 qui assure l’essentiel de la duplication de l’ADN.
Les ADN polymérases sont capables d’assembler des NT dans le sens 5’3’.
L’incorporation des désoxyriboNT est contrôlée uniquement par la complémentarité des
bases. La règle d’appariement avait été énoncée par WATSON et CRICK :
Dans un double brin d’ADN on a toujours une A en face d’une T et une C en face d’une
G.
La fiabilité de la duplication est possible grâce à l’activité exonucléasique de certaines
polymérases : elles vont arracher des bases de 3’ en 5’ (inverse de la synthèse), c’est ce qu’on
appelle la propriété de relecture et de correction. Lorsqu’une mauvaise base est incorporée,
il y a modification de la structure spatiale de l’ADN, avec une modification de volume,
l’ADN polymérase III va corriger son erreur.
Polymérase I Réplication (élimination AR) et réparation
Polymérase II Réparation
Polymérase III Réplication
Polymérase IV Réparation
Polymérase V Réparation
b) mécanisme de l’élongation chez E. Coli
Document 10-11-12
La phase d’élongation de la réplication comporte deux opérations distinctes qui s’effectuent
simultanément au niveau de la fourche de réplication. C’est la synthèse du brin avancé (=
continu, direct) et la synthèse du brin retardé (=discontinu, indirect).
Pour que ces 2 synthèses commencent, il faut que les 2 brins d’ADN aient été séparés et que
la primase ait synthétisé un morceau d’ADN de 10 NT. A ce moment-là, l’ADN polymérase
III va chasser les protéines SSB et va pouvoir assembler les désoxyriboNT au fur et à mesure
que l’hélicase déroule l’ADN et que la gyrase élimine les super-tours.
La synthèse du brin avancé va avoir lieu jusqu’à ce que la réplication du brin soit terminée.
La synthèse du brin retardé se fera de façon discontinue par morceaux de 1000 à 2000 NT. Ce
sont les fragments d’Okazaki. Sur ce brin on va donc avoir un mélange d’ADN et d’ARN.
L’ADN polymérase I, grâce à son activité exonucléasique va éliminer l’ARN et resynthétiser
de l’ADN, c’est une ligase qui permettra de relier les différents brins.

Biochimie
Chapitre 10 – Réplication, transcription et traduction de l’information génétique
- 4 -
3) Terminaison
Chez E. Coli la terminaison a lieu lorsque les 2 fourches se rejoignent.
4) Cas des EuK
Les Xmes sont linéaires et non circulaires, les extrémités sont appelées télomères. La
réplication est effectuée par des mécanismes différents, c’est une télomérase qui fait ce
travail.
Il existe 5 ADN polymérases chez les EuK :
- polymérase α réplication ADN nucléaire, pas d’activité exonucléasique, une autre
polymérase corrigera les erreurs.
- polymérase β réparation ADN
- polymérase γ réplication ADN mitochondrial
- polymérase δ peut être correction d’erreurs de la polymérase α (activité
exonucléasique)
- polymérase ε système de réparation
III. La transcription ou biosynthèse des ARN
Les mécanismes de TC ont été d’abord étudiés chez les ProK (facile), en particulier chez E.
Coli. Durant la TC un morceau d’ADN appelé « unité de TC » codant pour un produit défini
appelé « gène » va servir de matrice à la synthèse de différents ARN :
- ARNmessager correspondant aux gènes de structures codant pour des protéines.
Généralement ces gènes n’existent qu’à un exemplaire.
- ARNribosomaux vont entrer dans la constitution des ribosomes et font partie de la
machine de TD.
- ARNtransfert, ceux-ci vont se lier aux AA et vont les amener aux ribosomes pour
synthétiser une protéine. Les gènes codant pour les ARNR et les ARNT sont répétés
plusieurs fois.
Le processus de TC rappelle celui de la réplication. En effet l’ARN polymérase a besoin d’un
modèle, c’est le brin matrice. La synthèse de l’ARN se fait côté 3’OH. Par contre, elles n’ont
pas besoin d’amorce.
A. Mécanisme de la transcription
1) Initiation
L’initiation de la TC est due à la reconnaissance par l’ARN polymérase de séquences
particulières. Ces séquences d’ADN sont dites promotrices. Ces sites promoteurs ont été
identifiés et caractérisés. Ils présentent des séquences consensus qui vont être reconnues par
la sous unité α de l’ARN polymérase.
On voit une séquence à -10 bases (avant le début du gène) très conservée appelée le
« tatabox » et une séquence à -35 bases qui vont être les séquences reconnues. Une troisième
séquence placée plus en amont entre -40 et -60 bases appelée « upstream promoteur »
apparait fréquemment devant les gènes très exprimés. Suivant la force de ces séquences
(intensité d’expression) l’ARN polymérase se fixe plus ou moins efficacement.
Les 2 brins d’ADN vont se dissocier au niveau de la tatabox, dans cette zone il n’y a que 2 LH
entre les bases complémentaires A et T. Il faudra donc moins d’énergie pour les séparées.
Le site de début de la TC se situe à +1 et c’est toujours une A ou une G
Document13
2) Elongation de la chaîne d’ARN
a) L’ARN polymérase (α2ββ’σ)
On connait une seule ARN polymérase chez les ProK, elle fait 400 kDa et elle est constituée
de 4 sous-unités différentes (dont une est répétée 2 fois) => α2ββ’σ.
b) Mécanisme de l’élongation chez E. Coli

Biochimie
Chapitre 10 – Réplication, transcription et traduction de l’information génétique
- 5 -
Les NT sont ajoutés comme pour l’ADN côté 3’OH. L’ARN polymérase se déplace sur le
brin matrice de l’extrémité 3’ vers l’extrémité 5’. Ce qui lui permet de respecter le sens de
synthèse.
L’ARN polymérase se déplace à une vitesse de 50 à 90 NT par seconde. Elle provoque un
déroulement du double brin d’ADN, transitoire sur 17 paires de bases.
Sur les 2 brins d’ADN qui sont en vis-à-vis, un seul va être TC. Il est dit brin TC ou brin
matriciel ou brin antisens. La séquence de l’ARN TC sera la même que celle du brin qui ne
sert pas de matrice sauf que les T sont remplacées par des U. C’est ce brin qui ne sert pas de
matrice qui est appelé brin codant ou brin sens.
Durant le phénomène de TC on observe de façon transitoire la formation d’un hybride
ADN/ARN, les 2 brins se séparent au fur et à mesure du mécanisme.
L’ARN synthétisé va se détaché de la matrice d’ADN au niveau de la fourche de TC ce qui
permettra aux 2 brins d’ADN de se réassocier. Dans ce mécanisme on n’a pas mis en évidence
la présence de topoisomérase.
On n’a pas identifié d’activité exonucléasique chez l’ARN polymérase ce qui fait penser qu’il
y a peut être plus d’erreurs à la TC qu’à la réplication. Il ne semble pas y avoir de correction.
Pour un gène particulier, le brin codant peut être sur l’un ou l’autre des 2 brins d’un Xme
donné. 3) Terminaison
Documents 14
La terminaison de la TC aura lieu lorsque l’ARN polymérase va libérer la matrice d’ADN et
l’ARN synthétisé. Le signal de fin de TC est une séquence dite « palindromique ». Elle
donnera à l’extrémité 3’ de l’ARN une structure dite en « épingle à cheveux » qui à sa
formation provoquera l’éjection de la polymérase. Cette séquence se termine par 4 U parfois
la présence d’une protéine supplémentaire, la protéine rhô (ρ) est nécessaire pour éjecter la
polymérase.
4) Cas des EuK
B. Différences dans la Tc entre Euk et ProK
1) Cas des ProK
2) Cas des EuK
IV. Traduction de l’information génétique : la biosynthèse des protéines
A. Déroulement général de la protéosynthèse
1) Définition
2) L’ARNt : adaptateur traductionnel
a) Structure et propriétés de l’ARNt
b) Activation des AA
 6
6
1
/
6
100%