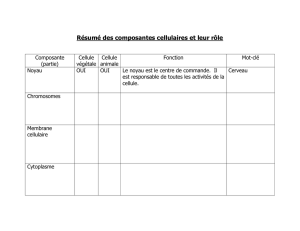
La radioactivité

1
La radioactivité
Introduction.
La radioactivité constituera notre première étude des phénomènes nucléaires (relatifs au
noyau de l’atome).
On explicitera la nature et l’origine de la radioactivité, puis on dégagera la loi d’évolution
temporelle d’un échantillon radioactif, appelée loi de décroissance radioactive.
I. Rappels sur le noyau atomique.
1. La composition du noyau.
Le noyau atomique est constitué de nucléons de deux types différents : les neutrons et les
protons.
- Le neutron.
Comme son nom l’indique, le neutron est une particule neutre de masse
mn = 1,675 10-27 kg.
L’unité de masse atomique.
Le kilogramme est une unité mal adaptée à l’échelle atomique ou nucléaire, on préfère
souvent utiliser l’unité de masse atomique de symbole u (une unité de masse atomique est
égale au 1/12 de la masse d’un atome de carbone isotope 12).
1 u = 1,66054 10-27 kg.
Dans cette unité, on a mn = 1,0086 u
- Le proton.
Le proton est une particule chargée positivement, sa masse a pour valeur :
mp = 1,673 10-27 kg = 1,0072 u (masse légèrement inférieure à celle du
neutron)
Sa charge est la charge électrique élémentaire :
e = 1,6 10-19 C
Les noyaux se distinguent donc les uns des autres par leurs nombres respectifs de neutrons et
de protons.
- On note Z, appelé nombre de charge ou numéro atomique, le nombre total de
protons contenu dans le noyau (la charge du noyau est donc égale à Ze).
- On note A le nombre total de nucléon du noyau.
Si N est le nombre de neutrons, on a donc A = N + Z (ou N = A – Z).
La composition d’un noyau est donc parfaitement déterminé par la donnée des nombres
Z et A.

2
On associe à ce noyau, parfois appelé nucléide pour bien le distinguer de l’atome
correspondant, un symbole X, le noyau est alors symboliquement noté :
X
A
Z
.
Exemple : le noyau constitué de 6 protons et 6 neutrons est le noyau de carbone noté
C
12
6
.
Remarque :
En fait X est aussi le symbole de l’élément chimique correspondant au noyau, celui-ci ne
dépend que de la valeur de Z (qui détermine le cortège électronique dans l’atome).Exemples :
Z = 6 : carbone ; Z = 8 : oxygène ; Z = 11 : sodium ;…
Le neutron pourra être noté
n
1
0
.
Le proton pourra être noté
p
1
1
.
2. La cohésion du noyau.
La cohésion du noyau, c'est-à-dire le fait que les nucléons restent regroupés au sein du noyau
malgré la répulsion électrique des protons chargés positivement, est dû à l’existence d’une
interaction particulière entre les nucléons, appelée interaction forte.
Les dimensions d’un noyau sont de l’ordre de 10-15 m (10-15 à 10-13 m).
3. Les isotopes.
Il existe des noyaux ayant le même nombre de proton (même Z), qui correspondent donc au
même élément chimique, mais qui ont des nombres de neutrons différents ( A différents) :
ceux sont des isotopes.
Ecriture générale de deux isotopes :
X
A
Z1
et
X
A
Z
2
.
Exemple :
O
16
8
(99,76 % de l’oxygène naturel) ;
O
17
8
(0,04 %) ;
O
18
8
( 0,2 %)
L’isotopie est extrêmement courante, il existe environ 350 isotopes différents pour environ 90
éléments chimiques naturels ; pratiquement tous les éléments présentent différents isotopes.
L’abondance isotopique est caractérisée par le pourcentage d’un isotope donné présent dans
un élément chimique. Ce pourcentage isotopique est indépendant de l’origine géographique
de l’élément chimique.
On peut « fabriquer » des éléments chimiques et des isotopes artificiels en utilisant
notamment les accélérateurs de particules (ces éléments artificiels sont généralement
instables).
Remarque fondamentale.
Deux isotopes ont généralement des propriétés chimiques très voisines (ayant la même valeur
de Z, ils ont le même cortège électronique), ils peuvent cependant avoir des propriétés
physiques différentes et notamment vis-à-vis des phénomènes radioactifs (par exemple le
carbone 12 est stable alors que le carbone 14 est radioactif).

3
II. Le phénomène de radioactivité.
1. Historique.
Becquerel constate en 1896 que certains composés chimiques (des sels d’uranium), sont
capables d’impressionner une plaque photographique dans l’obscurité totale.
Pierre et Marie Curie mettent en évidence quelques années plus tard que cette « activité » est
dû au noyau atomique : il s’agit d’un phénomène nucléaire.
2. Les différents types de radioactivité.
Les études ultérieures ont montré que la radioactivité se traduit par l’émission par le noyau de
particules ou de rayonnements énergétiques, responsables de l’impression de la pellicule
photographique.
C’est également l’énergie de ces particules et rayonnement qui permet de les détecter grâce à
des compteurs de radioactivité, ou d’obtenir des radiographies utilisant la radioactivité
(gammagraphie).
Il existe trois types de radioactivité.
2.a. La radioactivité α.
Le noyau (le nucléide) émet ici, lors de sa désintégration, une particule α qui est en fait un
noyau d’hélium
He
4
2
(la particule α a une charge positive égale à 2e).
Cette particule est émise avec une vitesse de l’ordre de 20 000 km.s-1 et est facilement arrêtée
(une feuille de papier suffit) ; c’est une particule à faible pénétration.
2.b. La radioactivité
.
Le noyau émet une particule
qui est en fait un électron
e
0
1
.
L’émission d’un électron par le noyau peut s’interpréter par la transformation d’un neutron en
un proton à l’intérieur du noyau, avec libération d’un électron :
n
1
0
→
p
1
1
+
e
0
1
.
La particule
est émise à une vitesse d’environ 280 000 km.s-1 (c'est-à-dire proche de la
célérité c de la lumière dans le vide) ; elle est plus pénétrante que la particule α (arrêtée par
quelques millimètres d’aluminium).
2.c. La radioactivité
.
Le noyau émet une particule
qui est un positon, c'est-à-dire l’antiparticule de l’électron
(même masse que l’électron mais charge opposée). Symbole du positon :
e
0
1
.
L’émission d’un positon par le noyau peut s’interpréter par la transformation d’un proton en
un neutron à l’intérieur du noyau, avec libération d’un positon :
p
1
1
→
n
1
0
+
e
0
1
.
La particule
est émise à une vitesse d’environ 280 000 km.s-1 (c'est-à-dire proche de la
célérité c de la lumière dans le vide) ; elle est plus pénétrante que la particule α (arrêtée par
quelques millimètres d’aluminium).

4
2.d. Le rayonnement γ.
Le plus souvent la désintégration radioactive, quelle soit du type α,
ou
, s’accompagne
de l’émission d’un rayonnement électromagnétique de très courte longueur d’onde
(λvide ≈ 10-4 nm), appelé rayonnement γ.
Ce rayonnement est extrêmement pénétrant (il faut des barrière très épaisses de béton ou de
plomb pour l’arrêter).
3. Ecriture des désintégrations radioactives.
3.a. Radioactivité α.
- Etude d’un exemple.
Le noyau d’uranium 238
U
238
92
est radioactif α. Il va donc émettre une particule α lors de sa
désintégration et se transformer (on dit se transmuter) en un nouveau noyau Y. On peut
écrire :
U
238
92
→
He
4
2
+
Y
A
Z
On dit que le noyau d’uranium est le noyau père et que Y est le noyau fils.
Pour connaître la structure du noyau fils, on utilise deux lois de conservation fondamentales
au niveau nucléaire :
- Conservation de la charge électrique totale : la charge électrique totale reste
inchangée au cours de la désintégration.
- Conservation du nombre total de nucléons : le nombre total de nucléons reste
inchangé au cours de la désintégration.
Par application de la première loi, on obtient :
92 = 2 + Z ; d’où Z = 92 – 2 = 90 ; il s’agit du numéro atomique du thorium
Th
90
.
Par application de la seconde loi, on obtient :
238 = 4 + A ; d’où A = 238 – 4 = 234 ; le noyau fils est donc un noyau de thorium 234
Th
234
92
.
On peut finalement écrire :
U
238
92
→
He
4
2
+
Th
234
92
Cette écriture constitue l’équation de la réaction de désintégration.
- Cas général.
De façon général, et compte tenu des lois de conservation, la désintégration α d’un noyau
X
A
Z
s’écrira sous la forme :
X
A
Z
→
He
4
2
+
Y
A
Z4
2
3.b. Radioactivité
.
- Etude d’un exemple.
Le noyau de cobalt 60
Co
60
27
est radioactif
; on peut donc écrire, en notant
Y
A
Z
le noyau
fils :

5
Co
60
27
→
e
0
1
+
Y
A
Z
En utilisant les lois de conservation, on obtient les relations :
27 = -1 + Z ; d’où Z = 27+1 =28 , il s’agit d’un noyau de nickel
Ni
28
.
60 = 0 + A ; d’où A = 60, le noyau fils est un noyau de nickel 60
Ni
60
28
.
On peut finalement écrire :
Co
60
27
→
e
0
1
+
Ni
60
28
- Cas général.
De façon général, et compte tenu des lois de conservation, la désintégration
d’un noyau
X
A
Z
s’écrira sous la forme :
X
A
Z
→
e
0
1
+
Y
A
Z1
3.c. Radioactivité
.
- Etude d’un exemple.
Le noyau de néon 19
Ne
19
10
est radioactif
; on peut donc écrire, en notant
Y
A
Z
le noyau fils :
Ne
19
10
→
e
0
1
+
Y
A
Z
En utilisant les lois de conservation, on obtient les relations :
10 = 1 + Z ; d’où Z = 10 – 1 = 9 ; il s’agit d’un noyau de fluor
F
9
.
19 = 0 + A ; d’où A = 19 ; le noyau fils est un noyau de fluor 19
F
19
9
.
On peut finalement écrire :
Ne
19
10
→
e
0
1
+
F
19
9
- Cas général.
De façon général, et compte tenu des lois de conservation, la désintégration
d’un noyau
X
A
Z
s’écrira sous la forme :
X
A
Z
→
e
0
1
+
Y
A
Z1
3.d. Origine du rayonnement γ.
Très souvent, quelque soit le type de radioactivité, le noyau fils est créé dans un état excité,
c'est-à-dire qu’il possède un « excédent » d’énergie ; il est alors noté Y*.
Il retourne alors à un état stable en émettant cet excédent d’énergie sous la forme d’un
rayonnement γ.
On peut traduire ce phénomène sous la forme :
*
Y
A
Z
→
Y
A
Z
+ γ
(Remarque : On peut noté le rayonnement γ «
0
0
» ; les lois de conservations sont toujours
vérifiées).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%