correction

Physique Chapitre …… : les ondes électromagnétiques visibles
I- LA DECOMPOSITION DE LA LUMIERE
1- Lumière blanche
La lumière émise par le Soleil ou par une lampe à incandescence s’appelle la lumière
blanche.
On remarque (lors d’un arc-en ciel, ou sur le reflet d’un CD ou, en physique, lorsque cette
lumière traverse un prisme) que la lumière blanche est en fait composée de toutes les
lumières colorées visibles par l’œil humain.
On dit qu’on observe le spectre de la lumière blanche : C’est un spectre continu s’étalant du
violet au rouge.
On dit que la lumière blanche est polychromatique.
2- Lumière du laser
Avec un Laser, on n’observe pas de spectre continu : le spectre est composé d’une seule
raie (une raie rouge par exemple).
On dit que la lumière du Laser est monochromatique.
Un faisceau Laser est très directif (il ne « s’étale » pas comme la lumière d’un lampe de
poche)
Un faisceau Laser peut aussi avoir une très grande puissance surfacique (il peut perforer de
l’acier).
On utilise le Laser en médecine car le faisceau est fin et précis et son énergie est réglable.
(livre p.49-50)
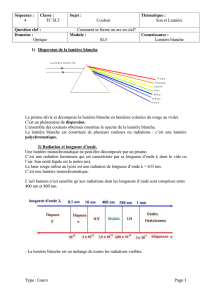
II- LA LONGUEUR D’ONDE
1- Définition
Une lumière monochromatique est appelée une radiation.
Elle est caractérisée par une grandeur appelée longueur d’onde, notée (lambda) et qui
s’exprime en mètres.
2- Les différentes radiations
Les radiations visibles par l’œil humain correspondent aux radiations dont les longueurs
d’onde vont de 400 à 800 nm
Remarque sur les conversions : 1nm = 10-9 m = 0,000 000 001 m
Couleur
violet
bleu
vert
jaune
orange
rouge
Longueur
d’onde en nm
400-425
425-491
491-575
575-585
585-647
647-800
La lumière émise par le Soleil et les lampes à incandescence contient des radiations qui ne
sont pas visibles par l’œil humain :rayons X, ultraviolets, infra-rouge

III- Absorption de la lumière par une solution
Lorsque la lumière traverse une solution colorée, une partie est absorbée par la solution, une
autre partie est transmise et arrive jusqu’à nos yeux.
1- Le spectre d’absorption
Le spectre de la lumière qui a traversé une solution colorée présente une bande noire, qui
correspond aux radiations que la solution a absorbées : on dit qu’on observe le spectre
d’absorption de la solution.
La couleur absorbée correspond à la couleur complémentaire de
celle de la solution. (sur le schéma suivant, la couleur
complémentaire est située en face de la couleur : ex : le jaune est la
couleur complémentaire du bleu, et inversement)
Exemple : la solution est de couleur verte
La couleur complémentaire est le magenta (violet)
Son spectre d’absorption présente une bande noire
qui correspond au domaine du violet
2- La courbe d’absorption
On appelle absorbance, notée A, (sans unité) la capacité d’une solution à absorber certaines
radiations.
Ex : Si une solution laisse passer les radiations rouges, son absorbance est environ égale à
zéro pour les longueurs d’onde allant de 647 à 800 nm
Si cette solution absorbe (ne laisse pas passer) les radiations vertes, son absorbance
est grande pour les longueurs d’onde allant de 491 à 575 nm.
La courbe d’absorbance est le graphique de l’absorbance A (en ordonnées) en fonction de la
longueur d’onde en mètre ou en nm (en abscisses).
Ex : Une solution absorbe les radiations les radiations de longueur d’onde allant de 520 à 580
nm. Dessiner l’allure de sa courbe d’absorbance et colorier son spectre d’absorption.
Absorbance A
Longueur d’onde (nm)
1
/
2
100%