chapB09-Les molecules - leprof

Page 1 sur 3
Chap.9 Les molécules de la santé
I. Règle de l’octet et du duet
Règle du « duet » :
Au cours de leurs transformations chimiques, les atomes de numéro atomique inférieur ou égal à 4 (Z
4)
évoluent de manière à acquérir un « duet » d'électrons.
Règle de l' octet :
Au cours de leurs transformations chimiques, les atomes de numéro atomique supérieur à 4
(Z > 4) évoluent de manière à acquérir un octet d'électrons sur leur couche externe.
II. Molécules
1-Exemples de molécules
Une molécule est formée d’atomes associés.
Chaque atome étant électriquement neutre, une molécule est donc électriquement neutre.
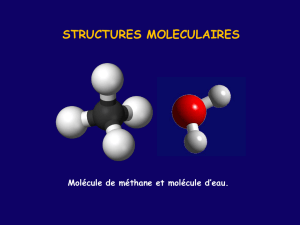
Voir T.P. avec modèles moléculaires et tableau ci-dessus
2- La liaison covalente
Une liaison covalente entre deux atomes correspond à la mise en commun de deux électrons de leurs couches
externes pour former un doublet d’électrons appelé doublet liant.
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d'électrons qu'il doit
acquérir pour saturer sa couche externe à un octet d’électrons.

Page 2 sur 3
3- Représentation des molécules
a- La formule brute
Elle comprend le symbole de l’élément et le nombre d’atomes présents dans la molécule en indice à droite
du symbole b- La représentation de Lewis
La représentation de Lewis d’une molécule représente les atomes et les doublets liants et non liants.
Par convention, le doublet liant est représenté par un trait entre les symboles des atomes et les doublets non
liants d’un atome sont représentés par des traits à coté de l’atome en tenant compte de la répulsion des
électrons entre eux.
Remarque :
Autour de chaque noyau, il y a autant d’électrons que dans un atome du gaz rare de numéro atomique le plus
proche de cet atome. Il suit la règle de l’octet.
c- La formule développée
Elle ne représente que les doublets liants entre les atomes par des tirets, elle indique l’ordre d’assemblage
des atomes, tous les atomes de la molécule sont représentés.
d- La formule semi développée
Les tirets représentant les liaisons avec les atomes d’hydrogène n’apparaissent pas, on précise le nombre
d’atome d’hydrogène par un indice en bas à droite du symbole H
III. Isomérie
Des isomères sont des composés qui ont la même formule brute mais des formules développées différentes
C2H6O CH3 CH2 OH éthanol
Ou CH3 O CH3 oxyde de méthyle ou métoxyméthane
Le C4H10 butane ou méthylpropane
Quels sont les isomères de C5H12, et C6H14
IV. Structure des molécules organiques
1- Constitution d’une molécule organique
Les molécules du domaine vivant contiennent essentiellement les éléments carbone, hydrogène, oxygène et
azote (C, H, O, N), ce sont des molécules organiques, elles sont constituées d’une chaine d’atomes de
carbone reliés entre eux, la chaine carbonée sur laquelle sont fixés d’autres atomes ou groupes d’atomes.
Exemple : la thréonine est un acide aminé parmi les 20 constitutifs des protéines.
2- Nomenclature
Le groupe caractéristique principal donne la terminaison du nom.
On cherche la chaîne carbonée la plus longue contenant le groupe principal et le préfixe est donné par le
nombre d’atome de carbone.
1C : méth
2C : éth
3C : prop
4C : but
5C : pent
6C : hex
7C : hept
8C : oct
9C : non
10C : dec
Ensuite on cherche à obtenir le plus de petits groupes possibles, plutôt que des gros groupes qui portent la
terminaison yle , s’il y en a plusieurs identiques, di, tri, tétra, penta…
On numérote la chaine carbonée pour donner le plus petit nombre à ces groupes que l’on place par ordre
alphabétique dans le nom de la molécule, sachant que le groupe fonctionnel est prioritaire sur les groupes
méthyle, éthyle propyle etc.

Page 3 sur 3
3- Les groupes caractéristiques
Un groupe caractéristique est un groupe d’atome qui donne des propriétés particulières à la molécule.
S’il n’y a pas de groupe caractéristique la terminaison est –ane
Formule
Fonction
Groupe caractéristique
Nomenclature
– OH
alcool
Hydroxyle
-ol
aldéhyde
Carbonyle
-al
cétone
Carbonyle
-one
Ester
Ester
…oate de ….yle
Acide
carboxylique
Carboxyle
acide ………oïque
R—NH2
amine
amine
-amine
amide
amide
-amide
4- Exemples
éthanol CH3 CH2 OH 4,4 diméthylpentan-2-ol
éthylamine CH3 CH2 NH2
propanal c’est un aldéhyde propanone (ou acétone)
pentan-2-one
Acide acétique éthanamide
éthanoate de 3-méthylbutyle
CH3C CH2
CH3
CH3
CH CH3
OH
5 4 3 2 1
CH3C CH2
O
CH2CH3
1 2 3 4 5
CO
OH
C
O
OR’
CO
O
CH3CH2CH2CH CH3
CH3
1 2 3 4
1
/
3
100%