I. L`élément cuivre

16/04/2017 582691553 1/2
2nde
Thème : Univers
TP n°3
Chimie
L’élément cuivre
Chap.4
But du TP : Réaliser des réactions chimiques mettant en évidence l’élément cuivre sous diverses formes.
I. L’élément cuivre
Le cuivre pourrait bien être le premier métal à avoir été utilisé par l’homme, étant donné que des objets en cuivre
datant de 8700 avant J.-C. ont été trouvés. C’est un métal rouge, mais on le rencontre vert-de-gris sur les coupoles
de monuments, bronze lorsqu’il est allié à l’étain etc…
Au cours de ce TP, vous allez étudier l’élément cuivre et réaliser des réactions chimiques permettant de passer
d’une de ses formes à une autre (voir le tableau ci-contre).
Espèce chimique
Formule
Etat physique
Couleur
Le métal cuivre
Cu
Solide
Rouge
L’ion cuivre II
Cu2+
Solution liquide
Bleu
L’oxyde de cuivre II
CuO
Solide
Noir
L’hydroxyde de cuivre
Cu(OH)2
Solide
Bleu
Questions :
1.1. En chimie, qu’est-ce qu’un réactif ? Qu’est-ce qu’un produit ?
1.2. Vous allez utiliser des liquides dangereux comme l’acide nitrique concentré dont le
pictogramme est ci-contre. Que signifie ce pictogramme ?
II. Protocole expérimental
Pour chaque expérience, observez et notez ce qui se passe. Les schémas demandés devront être clairs, colorés et
légendés.
1. Action de l’acide nitrique HNO3 (solution incolore) sur le métal cuivre Cu
Sous la hotte : Manipulation faite par le professeur : Dans un tube à essais, verser soigneusement 2 mL
d’acide nitrique pur.
Ajouter un morceau de cuivre. Un gaz roux très toxique est produit appelé dioxyde d’azote (formule : NO2).
Lorsque la réaction est terminée, vous verserez de l’eau pour faire apparaître une solution limpide bleue (c’est
celle qui nous intéresse).
1.1. Dessiner le tube à essais avant, pendant et après la transformation chimique.
1.2. Quels sont les deux réactifs et les deux produits identifiés lors de cette réaction chimique ?
2. Action des ions hydroxyde HO - sur les ions cuivre Cu2+
Verser la solution obtenue dans un petit erlenmeyer.
Avec précautions, ajouter une solution de soude (ou solution d’hydroxyde de sodium) contenant des ions HO-
jusqu’à l’apparition d’un précipité bleu d’hydroxyde de cuivre. Remuer l’erlenmeyer et rajouter de la soude
jusqu’à ce que le précipité persiste.
2.1. Dessiner l’erlenmeyer avant, pendant et après la transformation chimique.
2.2. Quels sont les deux réactifs et le produit identifié lors de cette réaction chimique ?
3. Déshydratation de l’hydroxyde de cuivre Cu(OH)2
Chauffer l’erlenmeyer doucement sur la plaque chauffante jusqu’à l’apparition d’un solide noir. On réalise ainsi
la déshydratation de l’hydroxyde de cuivre, c’est-à-dire que la molécule Cu(OH)2 perd une molécule d’eau H2O.
3.1. Dessiner l’erlenmeyer avant, pendant et après la transformation chimique.
3.2. Quel produit s’est formé au cours de cette déshydratation ?
3.3. Ecrire l’équation de la réaction de déshydratation (avec les formules).
4. Action de l’acide sulfurique H2SO4 sur l’oxyde de cuivre CuO
Dans l’erlenmeyer encore tiède, verser quelques millilitres d’acide sulfurique afin de faire disparaître le solide
noir.
4.1. Dessiner l’erlenmeyer avant, pendant et après la transformation chimique.
4.2. Quels sont les deux réactifs et le produit identifié lors de cette réaction chimique ?
5. Action du fer Fe sur les ions cuivre Cu2+
Dans l’entonnoir, placer un morceau de coton pour le boucher (on réalise ainsi un filtre), puis y ajouter de la
paille de fer.
Placer un bécher sous l’entonnoir, puis verser lentement dans le filtre un peu de la solution bleue obtenue
précédemment : un solide rougeâtre doit apparaître.
5.1. Faire les schémas de l’expérience avant, pendant et après transformation chimique.
5.2. Quels sont les deux réactifs et le produit identifié lors de cette réaction chimique ?

16/04/2017 582691553 2/2
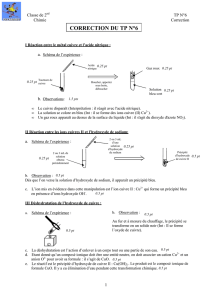
Action de l’acide nitrique
Métal cuivre
L’élément
............
Chauffage
...............................
..............................
...............................
..............................
...............................
..............................
III. Exploitation
1) Les transformations chimiques étudiées dans ce TP mettent en jeu différentes espèces chimiques.
Quel est le point commun entre toutes ces espèces ?
2) Compléter le schéma ci-dessous en indiquant :
Dans les cases : les différentes formes de l’élément chimique ;
Sur les flèches : les expériences effectuées.
Le nom de l’élément chimique
1
/
2
100%