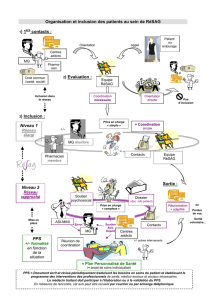
Le protocole - Club de Neuroprotection

SYNOPSIS
Titre de l'essai
Phase de l’étude
Investigateurs / Pays
Centres
Durée de l'essai
Objectifs
Principal
Secondaires
Méthodologie
Nombre de sujets
Diagnostic et
principaux critères
d'inclusion
Traitement à l'essai
Durée de traitement
Traitement de
comparaison
Critères d'évaluation
Efficacité
Critère principal :
Critères secondaires :
Tolérance
Recueil des événements intercurrents, examen clinique.
Méthodes statistiques

Le protocole
SOMMAIRE
DEROULEMENT DE L'ESSAI
1. INTRODUCTION
2. OBJECTIFS DE L'ESSAI
2.1. Objectif Principal
2.2. Objectifs Secondaires
3. SCHEMA GENERAL DE L'ESSAI
3.1. Description et Justification
3.2. Centres Investigateurs

3.3. Comité Scientifique
4. SELECTION DE LA POPULATION
4.1. Critères d'Inclusion
4.2. Critères de Non Inclusion
4.3. Critères d'exclusion secondaire
4.4. Traitements concomitants
4.4.4 Traitements interdits pendant toute la durée de l'essai.
5. DEROULEMENT DE L'ESSAI
5.1. Calendrier de l'Essai
5.2. Plan Détaillé
5.2.1. Visite d'Inclusion - V1
5.2.2. Visite de Suivi - V 2
5.2.3. Visite de Fin d'Essai - V3
5.2.4. Arrêt de Traitement / Sortie d'Essai
6. TRAITEMENT
6.1. Description des Traitements Etudiés
6.2. Méthode d'Allocation des Unités de Traitement
6.3. Conditionnement et Etiquetage
6.4. Stockage, Dispensation et Retour
6.5. Insu
6.6. Administration du Produit à l’Essai
6.7. Vérification de l’observance
7. EVALUATIONS
7.1. Méthodes d'Evaluation de l'efficacité
7.1.1. Critère Principal
7.1.2. Critères Secondaires
7.2. Méthodes d'Evaluation de la tolérance

8. EVENEMENTS INDESIRABLES - EVENEMENTS INTERCURRENTS
8.1. Définitions
8.2. Recueil des Evénements
8.3. Procédure à Suivre pour la Notification des Evénements Graves
8.5. Arrêt Prématuré de Traitement pour Evénement Indésirable
9. ANALYSE DES DONNEES
9.1. Nombre de Patients Nécessaire
9.2. Evaluation de l'efficacité
9.2.1. Paramètres d’efficacité
9.2.2. Définition des populations
9.2.2.1. Population en intention de traiter (ITT)
9.2.2.2. Population per protocole (PP)
9.2.2.3. Population de sécurité
9.2.3. Méthodes statistiques
9.2.4. Analyses d’efficacité
9.2.4.1. Analyse principale
9.2.4.2. Analyses secondaires
9.3. Evaluation de la Tolérance
9.3.1. Evénements intercurrents
9.3.2. Signes vitaux
10. OBLIGATIONS DE L'INVESTIGATEUR ET DU PROMOTEUR
10.1. Ethique
10.2. Modifications du Protocole
10.2.1. Amendements
10.2.2. Changements Administratifs
10.3. Audits et Inspection
10.4. Considérations administratives
10.4.1. Concernant l'Investigateur-Coordonnateur
10.4.2. Concernant l'Investigateur
10.4.3. Concernant le Pharmacien de l'Etablissement (si applicable)
10.4.4. Concernant le Directeur d'Etablissement (si applicable)
10.4.5. Concernant le Comité Scientifique
10.4.6. Concernant le Promoteur

10.5. Suivi de l'Essai
10.5.1. Visite de Pré-Essai
10.5.2. Visite de Mise en Place
10.5.3. Visite de Suivi
10.5.4. Visite de Fin d'Essai
10.6. Consentement Eclairé du Patient
10.7. Recueil des Données
10.8. Conservation des Documents - Identification des Patients
10.9. Responsabilité et Assurances
10.10. Confidentialité - Utilisation des Données et Publication des
Résultats
11. BIBLIOGRAPHIE
12. ANNEXES
13. APPROBATION DE L'INVESTIGATEUR
1. Définition de l’objectif
2. Sélection des sujets
3. Choix d’une méthode d’évaluation
4. Répartition des traitements par tirage au sort
5. Choix et standardisation des traitements comparés
6. Méthodes « aveugle »
7. Plan expérimental
8. Règles concernant les perdus de vus
9. Mesure de l’observance
10. Recueil des données
11. Essai multicentrique
12. Calcul de l’effectif nécessaire
13. Règles concernant les évènements indésirables
1
/
5
100%