corrigé - WordPress.com

Sciences 9e année
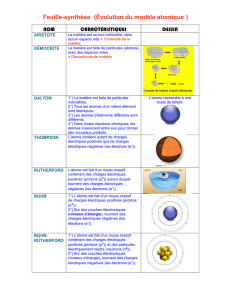
Chapitre 3 : Modèles atomiques
3.1 Construction de modèles de la matière
Environ 450 ans avant J.-C.
Empédocle, un savant grec, suggère que la matière est formée de
quatre éléments : la terre, l’air, le feu et l’eau.
Ex : la rouille = feu + terre, la roche = feu + air
Environ 400 ans avant J.-C.
Démocrite, un autre Grec, suggère que la matière est composée de
minuscules particules indécomposables appelées atomes, du
grec
atomos
, qui signifie indivisible.
Environ 350 ans avant J.-C.
Le grand et influent philosophe Aristote croit au modèle des quatre
éléments d’Empédocle et les gens continuent de croire à ce modèle
pendant 2000 ans.

En 1650
Robert Boyle, un scientifique anglais, ne croit pas aux quatre
éléments et invente la définition du mot élément :
une substance
pure indécomposable chimiquement en substances plus simples
.
Selon lui, l’air n’est pas un élément, mais un composé.
En 1808
Le chimiste anglais John Dalton propose le modèle atomique.
Voici les 4 postulats de la théorie atomique de Dalton :
La matière est composée d’atomes, des particules trop petites
pour être visibles;
Chaque élément possède ses propres atomes et sa masse
particulière;
Les composés sont formés grâce à la liaison entre les atomes
d’éléments différents, ce qui donne naissance à des
molécules;
Les transformations chimiques ne créent pas, ne détruisent
pas ou ne désintègrent pas les atomes.
Il croit que chaque atome ressemble à une boule de billard.

En 1831,
Michael Faraday découvre que les atomes peuvent être chargés
(ions) positivement ou négativement.
• La matière doit contenir des charges positives et négatives;
• Les charges opposées s’attirent et les charges identiques
se repoussent;
• Les atomes forment des molécules en raison de l’attraction
électrique entre eux.
C’est découverte à été fait grâce à l’électrolyse.
En 1904
J. J. Thomson découvre les électrons.
• Les atomes renferment des particules appelées électrons.
• Les électrons possèdent une faible masse et une charge
électrique négative.
• Le reste de l’atome est une sphère dotée d’une charge
électrique positive.

• Les électrons gravitent autour de cette sphère, de sorte
que les atomes associés sont neutres, c’est-à-dire sans charge
électrique. ( - et + s’annulent)
Le modèle atomique « Plum pudding » de J.J Tomson.
L’expérience qui a mené à la découverte des électrons.

En 1911
Ernest Rutherford, professeur à l’Université McGill de Montréal, fait
une expérience en bombardant une feuille d’or avec des particules
alpha (des minuscules particules positives) et propose le modèle
nucléaire :
• Un atome renferme un minuscule noyau massif de charge
positive, qui repousse les particules alpha et contient des
protons.
• Le noyau est entouré d’espace vide dans lequel les
électrons se déplacent rapidement, laissant passer les
particules alpha.
 6
6
 7
7
1
/
7
100%