LA SANTE LA PHYSIQUE AU SERVICE DU DIAGNOSTIQUE

LA SANTE
LA PHYSIQUE AU SERVICE DU DIAGNOSTIQUE MEDICAL
Exercices
Exercice n°1 : Calculez la fréquence de tous les signaux étudiés au cours du TP 1. Comment
évolue la fréquence d’un signal lorsque sa période augmente ? Diminue ?
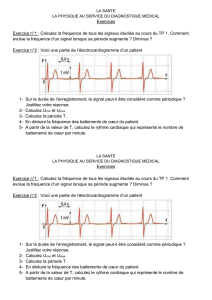
Exercice n°2 : Voici une partie de l’électrocardiogramme d’un patient
1- Sur la durée de l’enregistrement, le signal peut-il être considéré comme périodique ?
Justifiez votre réponse.
2- Calculez Umin et Umax.
3- Calculez la période T.
4- En déduire la fréquence des battements de cœur du patient.
5- A partir de la valeur de T, calculez le rythme cardiaque qui représente le nombre de
battements de cœur par minute.
LA SANTE
LA PHYSIQUE AU SERVICE DU DIAGNOSTIQUE MEDICAL
Exercices
Exercice n°1 : Calculez la fréquence de tous les signaux étudiés au cours du TP 1. Comment
évolue la fréquence d’un signal lorsque sa période augmente ? Diminue ?
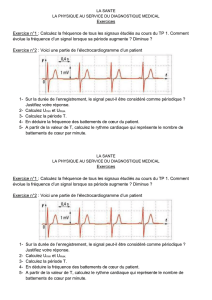
Exercice n°2 : Voici une partie de l’électrocardiogramme d’un patient
1- Sur la durée de l’enregistrement, le signal peut-il être considéré comme périodique ?
Justifiez votre réponse.
2- Calculez Umin et Umax.
3- Calculez la période T.
4- En déduire la fréquence des battements de cœur du patient.
5- A partir de la valeur de T, calculez le rythme cardiaque qui représente le nombre de
battements de cœur par minute.

LA SANTE
LA PHYSIQUE AU SERVICE DU DIAGNOSTIQUE MEDICAL
Exercices
Exercice n°1 : Calculez la fréquence de tous les signaux étudiés au cours du TP 1. Comment
évolue la fréquence d’un signal lorsque sa période augmente ? Diminue ?
Exercice n°2 : Voici une partie de l’électrocardiogramme d’un patient
1- Sur la durée de l’enregistrement, le signal peut-il être considéré comme périodique ?
Justifiez votre réponse.
2- Calculez Umin et Umax.
3- Calculez la période T.
4- En déduire la fréquence des battements de cœur du patient.
5- A partir de la valeur de T, calculez le rythme cardiaque qui représente le nombre de
battements de cœur par minute.
LA SANTE
LA PHYSIQUE AU SERVICE DU DIAGNOSTIQUE MEDICAL
Exercices
Exercice n°1 : Calculez la fréquence de tous les signaux étudiés au cours du TP 1. Comment
évolue la fréquence d’un signal lorsque sa période augmente ? Diminue ?
Exercice n°2 : Voici une partie de l’électrocardiogramme d’un patient
1- Sur la durée de l’enregistrement, le signal peut-il être considéré comme périodique ?
Justifiez votre réponse.
2- Calculez Umin et Umax.
3- Calculez la période T.
4- En déduire la fréquence des battements de cœur du patient.
5- A partir de la valeur de T, calculez le rythme cardiaque qui représente le nombre de
battements de cœur par minute.

LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.
LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.
LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.
LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.
LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.

LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.
LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.
LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.
LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.
LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercice
Les ions sont largement présents dans les médicaments car ils jouent un rôle essentiel dans
l’organisme. On donne la formule de certains de ces ions : Mg2+, Na+, Ca2+, Fe2+, Li2+, Cu2+ et Cl-.
Pour chacun de ces ions, recherchez sur internet le nom et le rôle qu’il joue dans l’organisme.

LA SANTE
DE L’ATOME A L’ELEMENT CHIMIQUE
Exercices
Exercice 1 : On considère un atome d’aluminium dont le noyau est composé de 13 protons et de 14
neutrons, et un atome de potassium dont le noyau est représenté par
K
39
19
.
1) Donner la représentation symbolique du noyau de l’atome d’aluminium.
2) Combien de nucléons les noyaux des atomes d’aluminium et de potassium comportent-ils ?
3) Combien d’électrons contiennent ces deux atomes ? Justifiez.
Exercice n°2 : On considère les atomes de néon et de sodium. Les symboles de leurs noyaux sont
Ne
20
10
et
Na
23
11
.
1) Quel est le numéro atomique de ces deux noyaux ? En déduire le nombre d’électrons que
contiennent ces atomes. Justifiez.
2) Donnez leur structure électronique.
3) Combien ont-ils d’électrons sur la couche externe ? Ces couches sont-elles saturées ?
Exercice n°3 : L’étiquette d’une bouteille d’eau minérale donne la liste des ions présents:
1) Quels sont les ions monoatomiques présents dans cette eau ?
2) A partir de quels atomes ces ions monoatomiques se sont-ils formés ? Précisez le nombre
d’électrons gagnés ou perdus lors de leur formation.
Exercice n°4 : On donne ci-contre la composition de différents
atomes et ions.
1) Quel est le point commun entre ces quatre entités
chimiques ? En quoi différent-elles ?
2) Identifiez les atomes et les ions monoatomiques.
3) Les atomes trouvés en 2) sont-ils isotopes ? Même
question pour les ions. Justifiez.
Exercice n°5 :
L’Autorité de Sûreté nucléaire (ASN) propose des comprimés
d’iodure de potassium aux habitants résidant dans un rayon de
10 km autour des centrales nucléaires françaises. Ces
comprimés doivent être avalés en cas de fuite d’iode radioactif
dans l’atmosphère. En effet, la glande thyroïde est un organe qui
a la capacité de fixer l’iode. La prise des comprimés permet de
fixer de l’iode non radioactif sur la thyroïde, à la place d’iode
radioactif comme l’isotope 131. L’iode présent dans les comprimés est stable, il s’agit essentiellement de
l’isotope 127. Le numéro atomique de l’iode est Z = 53.
1) L’ion iodure se forme lorsqu’un atome d’iode gagne un électron. Donnez sa formule en justifiant.
2) L’ion potassium se forme lorsqu’un atome de potassium perd un électron. Donnez sa formule en
justifiant.
3) Quel est la formule du composé appelé iodure de potassium ?
4) Indiquez la représentation symbolique des noyaux des isotopes de l’iode cités dans le texte, puis
précisez leurs compositions.
5) En quoi ces isotopes différent-ils ?
6) Les règles de remplissage indiquées dans le cours permettent-elles de déterminer la structure
électronique d’un atome d’iode ? Justifiez.
1
/
5
100%