1/9 Bioch.cours Bioénergétique. – Neel. Biochimie. Bioénergétique

Bioch.cours
Bioénergétique. – Neel.
1/9
Biochimie.
Bioénergétique.
Les organismes vivants ont un besoin constant d’énergie pour se maintenir en état. Le milieu
intérieur des êtres vivants est différent des milieux extérieurs. Les concentrations sont différentes à
l’intérieur et à l’extérieur.
Les cellules doivent renouveler leurs constituants cellulaires (protéines, organites…) ; D’autres
vont pouvoir subir des altérations et mourir, et doivent donc être remplacées. dans certains tissus, les
protéines sont renouveler mais les cellules aussi (GR : 120 jours ; cellules intestinales ≈ 48h.).
tout cela consomme de l’énergie.
De plus, chez les êtres jeunes, la croissance demande un surplus nécessaire à son bon
déroulement.
Dans le règne animal, les déplacements demandent de l’énergie (activité musculaire
oblige !!!). Les êtres homéothermes (à sang chaud) dépensent de l’énergie pour maintenir une
certaine température supérieure au milieu extérieur.
1er principe : L’énergie totale d'un système isolé est constante. La variation d’énergie d’un
système dépende de l’état finale (Ef) et de l’état initial (Ei) et non de la voie suivi pour obtenir cette
transformation.
L’entropie : c’est la mesure du degré de désordre d’un système.
Concrètement :
L’entropie (le désordre) de ce système a augmenté.
2ème principe : Un processus ne peut évoluer spontanément que si la somme des entropies
du système et du milieu extérieur augmente. (le désordre de l’univers augmente tout le temps).
Energie libre : E.
ΔG = ΔH – T.ΔS.
ΔG : variation de l’énergie libre. T : température (°C). ΔS : variation d’entropie
60°C
20°C
40°C
40°C

Bioch.cours
Bioénergétique. – Neel.
2/9
ΔH : variation de l’enthalpie = variation d’énergie + pression x variation de volume du système :
ΔH = ΔE + P.ΔV.
En biochimie, il n’y a pas de variation de volume donc :
ΔG = ΔE – T.ΔS.
La variation d’énergie libre est un critère pour savoir si une réaction peut se produire
spontanément (si ΔG < 0). ΔG est indépendant de na voie suivie. Il ne donne donc aucune indication
de la vitesse de réaction.
Avec la loi d’action de masse : A + B ↔ C + D d’où : ΔG = ΔG'0 + RT.ln
[C].[D]
[A].[B]
ΔG'0 : c’est la variation d’énergie libre standard, lorsque l’on part d’une concentration des réactifs A,
B, C, D de 1 molaire à un pH = 7 (et non pH = 0) et pour une concentration d’eau de 55,5 mol/L (=
un molaire).
A l’équilibre :
ΔG = 0 =
ΔG'0 + RT.ln
[C].[D]
[A].[B]
ΔG'0 = -RT.ln
[C].[D]
[A].[B]
Or Keq =
[C].[D]
[A].[B]
Keq : constante d’équilibre ΔG'0 = -RT.ln.Keq ΔG'0 = -2,303 RT.log10.Keq.
Remarque : le critère de spontanéité d’une réaction est ΔG et non ΔG'0.
Notion d’unité : la caloprie est la quantité d’énergie nécessaire pour faire augmenter la température
d’1g d’eau de 14,5°C à 15,5°C. (J : N.m-1 et 1 cal = 4,18 J.)
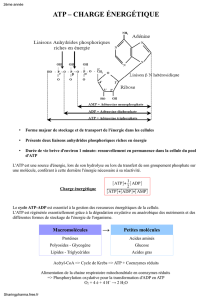
L’ATP : si l’être humain ne savait pas régénérer l’ADP en ATP, il consommerait près de 40 kg d’ATP
par jour.
ATP + H2O ↔ ADP + Pi.
( 7,3 Kcal suivant le sens de la réaction).
L’ATP est souvent utilisé par couplage avec un autre réaction dont le ΔG'0 est > -7,3 :
PEP Pyruvate + P -14,8 kcal ( couplé à la régénération de l’ATP).
G6P Glucose + P -3,8 kcal.

Bioch.cours
Bioénergétique. – Neel.
3/9
Grâce à la nucléotide diphosphate kinase d’autres nucléotides peuvent jouer le même rôle que
l’ATP comme donneur d’énergie :
Uridine : ATP + UDP ↔ ADP + UTP.
Guanine : ATP + GDP ↔ ADP + GTP.
Cystidine : ATP + CDP ↔ ADP + CTP.
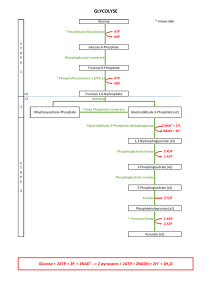
Les principales sources d’ATP proviennent de catabolismes. C’est le catabolisme du glucose
et des acides gras qui vont permettre ce cycle. On va donc obtenir de l’énergie en dégradant du
glucose et des lipides. Que ce soit d’origine primaire (végétaux) ou secondaire (animaux), l’origine
est liée aux photons solaires (photosynthèse) qui aident à synthétiser les glucoses primaires (amidon
par exemple) et les acides gras.
Si quelques ATP peuvent directement être formés du substrat, la majorité des ATP sont
formés par l’oxydation de groupements H2 avec NAD et FAD comme coenzymes au niveau de la
mitochondrie.
La partie du métabolisme commune aux lipides, glucides et partie carbonée des acides
aminés est le cycle de Krebs (tricarboxylique ou de l’acide citrique).
Le produit d’entrée dans le cycle de Krebs est l’acétyl-CoA, qui provient de la β-oxydation des
acides gras et de la décarboxylation de l’acide pyruvique (intramitochondrial du glucose). Cette
décarboxylation est irréversible.
Une fois en acétyl-CoA, on ne pourra plus atteindre une néosynthèse des acides gras (et
jamais de sucres avec des graisses néoglucogenèse).
ATP.
3-phopshoclycérol P.
PEP (phosphoénol pyruvate).
Donneur de P « riche » en énergie.
Phosphocréatine
(réservoir).
Glycérol-1-P.
Glucose-6-P
Accepteur de P « pauvre » en énergie.
~P.
–10,3 kcal.
~P.
–3,31 kcal.
~P.
-2,2 kcal.
~P.
-11,8 kcal.
~P.
-14,8 kcal.
Servent fabriquer
de l’ATP.
Utilise l’ATP par
couplage.
Tous < -7,3.
Tous > -7,3.
CH3––C–COO-
O
5 coenzymes : CoA-SH,
NAD, FAD, TPP, acide
lipoique.
CH3––C~S-CoA + CO2
O
Pyruvate déshydrogénase.
3 enzymes : Dihydrolipoiltransacétylase.
Dihydrolipoildéshydrogénase.
Pyruvate déshydrogénase.

Bioch.cours
Bioénergétique. – Neel.
4/9
Bilan du cycle de Krebs :
Il y a libération de 2 molécules de CO2, terminant l’oxydation de l’acétyl-CoA (2C venant de
l’acétyl-CoA).
Formation de 3 NADH + H+ et 1 FADH2 (pouvant être réoxydé en donnant leurs hydrogènes).
Il y a 3 molécules d’ATP produite par NADH, H+ oxydé et 2 molécules d’ATP par FADH2 produite.
1 ATP (quand passage de succinyl-CoA à succinate) 1.
3 ATP / NADH, H+ x 3 NADH, H+ : 9.
2 ATP / FADH2 x 1 FADH2 : 2.
Total : 12 ATP.
L’ATP inhibe allostériquement la citrate synthase (porte d’entrée de l’acétyl-CoA.)
L’ADP active l’isocitrate déshydrogénase (passage de l’isocitrate à α-cétoglutarate).
L’ATP active l’acide citrico-déshydrogénase ?
L’α-cétoglutarate déshydrogénase est inhibé par le succinyl-CoA (son produit) et par NADH, H+
(son coenzyme réduit).
Rôle amphibolique : c’est le rôle dans le métabolisme des acides aminés :
Glutamine α-cétoglutarate + NH2.
C’est le métabolisme des copules d’acides aminés.
Définition du Harper sur les voies amphiboliques : …Elles apparaissent aux « carrefours » du
métabolisme et servent de liens entre les noies anaboliques et cataboliques, par exemple, le cycle de
l’acide citrique.
Cas du propionyl-CoA :
O
H3C–CH2–C–S-CoA
Propionyl-CoA.
CO2 + H2O.
Propyonyl-CoA.
Carboxylase
(CoE : biotine B8)
O
H3C–CH2–C–S-CoA
C=O
OH
O
H3C–CH2–C–OH
C=O
S-CoA
D-méthyl-malonyl-CoA.
L-méthyl-malonyl-CoA.
Méthylmalonyl-CoA
racémase.
Méthylmalonyl-CoA
isomérase.
(CoE : vit. B12)
O
CH2–CH–C–OH
C=O H
S-CoA
Succinyl-CoA.
ATP.
ADP + Pi.

Bioch.cours
Bioénergétique. – Neel.
5/9
A noter également, le rôle du cycle de Krebs dans les réactions de néoglucogenèse :
Ceci permet d’augmenter le taux d’oxaloacétate (activateur allostérique d’acétyl-CoA) à
l’origine de la néoglucogenèse.
Le PEP
1
permet la synthèse du glucose (par la néoglucogenèse).
Le citrate : il peut servir pour faire sortir l’acétyl-CoA de la mitochondrie lors de la synthèse des
acides gras (l’acétyl-CoA ne pouvant franchir la membrane mitochondriale) :
Il est nécessaire de coupler le
cycle de Krebs avec la chaîne
respiratoire mitochondriale.
1
PEP : phosphoénol pyruvate.
Glycine + Succinyl-CoA.
Acide α-aminoacétoadipique.
Acide δ-aminolevulinique.
Porphobilinogène.
Hème : molécule de
l’hémoglobine.
Ala synthase.
Ala synthase.
Mitochondriale.
Condensation,
déshydratation.
Pyruvate + ATP + CO2 + H2O.
oxaloacétate + ADP + Pi.
Pyruvate carboxylase
(mitochondriale) + Mg2+.
Oxaloacétate + GTP
PEP + CO2 + GDP.
PEP carboxylase
(cytoplasme)
Citrate.
MITOCHONDRIE.
CYTOPLAMSE.
Citrate.
Oxaloacétate.
Acétyl-CoA.
Acides gras.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%