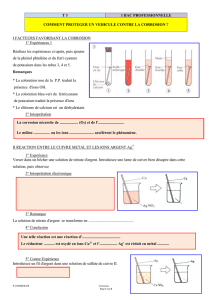
Partie IA : Notion de corrosion

ATELIER SCIENTIFIQUE 2002/2003
Équipe pédagogique :
Lycée Professionnel de Rompsay. La Rochelle
•Mohammed RAHMOUNE (Enseignant responsable)
•Yannick OLLIVIER
Partenaires Scientifiques :
Laboratoire d ’études des matériaux en milieux agressifs (LEMMA).
Université de La Rochelle
•René SABOT
•Juan CREUSE
•Otavio GIL
•Jean François DINHUT
Contact : Mohammed.Rahmoune@ac-poitiers.fr
Objectifs :
•Motiver les élèves à partir d ’un sujet technique concret
•Stimuler la curiosité scientifique et développer l ’esprit critique
•diffuser la culture scientifique
•Sensibiliser les élèves aux problèmes de l ’environnement
•Faire découvrir la recherche, sa mission et ses enjeux

AST – LP de ROMPSAY
1
SOMMAIRE
CARACTERISTIQUES DE L’ATELIER
PARTIE I : ACTIVITES EXPERIMENTALES
SECTION A :
NOTION DE CORROSION
INTERPRETATION ELECTROCHIMIQUE DE LA CORROSION
PROTECTION CONTRE LA CORROSION
SECTION B :
EXPERIENCES LUDIQUES BASEES SUR LES REACTIONS D’OXYDO-REDUCTION
PARTIE II : LES CONFERENCES
NOTION DE CORROSION : CAS CONCRETS
DIFFERENTS MECANISMES DE CORROSIONS
PROTECTION PAR REVETEMENTS
PROTECTION ANODIQUE ET CATHODIQUE
PARTIE III : ACTIVITES A L’EXTERIEUR DU LYCEE
VISITE DU LABORATOIRE D’ETUDE DES MATERIAUX EN MILIEUX AGRESSIFS
(LEMMA)
VISITE DES SITES DE PROTECTION AU PORT DES MINIMES A LA ROCHELLE
PARTICIPATION AU IV FESTIVAL DU TRES COURT METRAGE DE VULGARISATION
SCIENTIFIQUE A LA ROCHELLE
PLANNING DES ACTIVITES

AST – LP de ROMPSAY
2
CARACTERISTIQUES DE L’ATELIER
Présentation :
L’atelier compte douze élèves : sept élèves de la première baccalauréat professionnel (1BA)
maintenance des véhicules automobiles option bateaux de plaisance, deux élèves de la 1BA
maintenance des systèmes mécaniques automatisés et trois élèves de la terminale BEP
structures métalliques (voir liste jointe).
L’encadrement est assuré par deux professeurs du lycée professionnel de Rompsay :
M. Rahmoune et Y. Ollivier. Les intervenants extérieurs sont R. Sabot, J. Creuse et Otavio
Gil, maîtres de conférence à l’Université de la Rochelle.
L’atelier fonctionne à raison de deux séances par mois : le mardi de 13h à 14h30 pour des
activités expérimentales et le jeudi de 13h30 à 15h30 pour une conférence suivie d’un
échange.
Activités expérimentales :
Les élèves travaillent par binôme en respectant les consignes de sécurité. Ils réalisent des
expériences d’électrochimie qui permettent d’illustrer :
- Quelques types corrosions
- Les mécanismes d’actions
- Quelques produits de la corrosion
- Quelques agents responsables de la dégradation
- La prévention de la corrosion
- Quelques modes de protection
Les enseignants réalisent parfois des expériences d’oxydoréduction spectaculaires qui
permettent de vérifier l’acquisition du vocabulaire relatif à ce type de réactions ou de
sensibiliser les élèves aux problèmes de l’environnement et de gestion de déchets.
Conférences – échanges
Assistent à ces présentations en plus des membres de l’atelier quelques professeurs
d’enseignement professionnel
Les conférences portent sur deux thèmes :
- les différents types de corrosions ( René Sabot)
- la lutte contre la corrosion (Juan Creuse et Otavio Gil)

AST – LP de ROMPSAY
3
Ces vidéo projections traitent le sujet en 45 minutes. Les illustrations concrètes sont
abondantes, ce qui permet aux élèves de suivre sans difficulté.
Les élèves discutent ensuite le contenu de la présentation, ils posent aussi des questions
relatives aux activités expérimentales.
Une évaluation est également possible pendant l’échange. Il a été demandé par exemple aux
élèves de reconnaître quelques types de corrosions sur des échantillons réalisés au laboratoire.
Quelques expériences amusantes sont aussi réalisées et commentées.
Activités en dehors du lycée
- Visite du LEMMA assurée par J.F. DINHUT directeur du laboratoire
- Visite des sites de protection contre la corrosion à La Rochelle
- Participation au festival de court métrage de vulgarisation scientifique à La Rochelle
Liste des élèves participant à l’atelier scientifique
TBEPSM
1 BA MVA
1 BA MSMA
1- MINAUD BENOIT
2- NICOLAS THOMAS
3- VIELLERIBIERE ROMARIC
4- SOULAIMANA ATIBOU
5- DORAT AURELIEN
6- DOUILLARD ARNAUD
7- FRICO WILFRIED
8- GUILLEMET GUILLAUME
9- LOTODE ALEXIA
10- SALUDO YANN
11- DELEZAY ARNAUD
12- HARGUENDEGUY CLEMENT

AST – LP de ROMPSAY
4
PARTIE I : ACTIVITES EXPERIMENTALES
SECTION A :
NOTION DE CORROSION
INTERPRETATION ELECTROCHIMIQUE DE LA
CORROSION
PROTECTION CONTRE LA CORROSION
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
1
/
37
100%