2 Modèle d`études en bio du dvpt des plantes

LV302 – Plantes – Dernière mise à jour 01/10/08
1
Biologie et physiologie du développement végétal
1 Introduction 3
1.1 Rappels 3
1.1.1 Dvpt végétal versus dvpt animal 3
1.1.2 Rappels sur l’anatomie des plantes 4
1.1.3 Diversité des types biologiques 4
1.1.4 Cycle de dvpt d’une plante à fleur 5
1.2 La plante : un système intégré en interaction avec son environnement 5
1.2.1 Contraintes de la vie fixée : adaptations développementales et plasticité du végétal 5
1.2.2 Tropismes 5
1.2.3 Systèmes de perception des signaux 5
1.2.4 Les hormones : nature, métabolisme et effets multifactoriels 5
2 Modèle d’études en bio du dvpt des plantes 5
2.1 Plantes modèles 5
2.1.1 Antirinium (gueule de loup) 5
2.1.2 Arabidopsis thaliana 6
2.1.3 Choix de l’espèce modèle 6
2.2 Mutagenèse 6
2.2.1 Génération de mutant par l’insertion d’un gène dans un génome = mutagenèse insertionnelle 6
2.2.2 Nouvelle stratégie de mutagenèse insertionnelle utilisant Agrobactérium 8
2.2.2.1 Résumé : 9
2.2.2.2 Utilisation de Agrobacterium : 9
2.2.2.3 Exemple : faire des plantes transgéniques de tabac : 10
2.2.2.4 Insertions de gènes rapporteurs 10
2.2.2.4.1 Fusion transcriptionnelle 10
2.2.2.4.2 Fusion traductionnelle 11
2.2.2.5 La mutagenèse à l’aveugle 12
3 La plante : un système intégré en interaction avec son environnement 12
3.1 Contraintes de la vie fixée : adaptations développementales et plasticité du végétal 12
3.2 Systèmes de perception des signaux 12
3.3 Perception de la lumière 13
3.3.1 Capacité de percevoir la direction de la lumière = Phototropisme 13
3.3.2 Maîtrise de la germination et de la floraison grâce au phytochrome 13
3.3.2.1 Floraison 13
3.3.2.2 Germination 14
3.3.2.3 Effets de la lumière sur le dvpt de la jeune plantule 15
3.3.2.4 Caractéristiques de la molécule phytochrome 15
3.3.2.5 Structure et fonction du phytochrome (p13) 16
3.3.2.6 Mode d’action cellulaire des phytochromes 18
4 Les hormones végétales : nature, métabolisme et effets multifactoriels 19
4.1 Auxine 19
4.1.1 Bio$ de l’auxine 19
4.1.2 Mode d’action de l’auxine 19
4.1.3 Transport de l’auxine 21
4.1.4 Autres effets de l’auxine 21
4.1.5 Perception du signal : le mystère des récepteurs 21

LV302 – Plantes – Dernière mise à jour 01/10/08
2
4.2 Cytokinine 22
4.2.1 Historique 22
4.2.2 Bio$ (p16-17) 22
4.2.3 Les effets de la cytokinine 23
4.2.4 Transduction du signal 24
4.3 Les Gibbérellines ou Acides Gibbérellique GA 26
4.3.1 Fonction : 26
4.3.2 Historique : 26
4.3.3 Structure de la molécule et voie de bio$ 26
4.3.4 Effets des gibbérellines 27
4.3.5 Voie de transduction du signal 28
4.4 Acide abcissique (ABA) 28
4.4.1 Rôle, contraintes hydriques 28
4.4.2 Bio$ 28
4.4.3 Réponses à l’ABA 28
4.4.3.1 Transport de l’ABA pour réponse à la sécheresse 29
4.4.4 Résumé des effets de ABA (p23) 29
4.4.4.1 Experience sur les cellules de gardes des stomates 29
4.5 Ethylène C2H4 29
4.5.1 Bio$ de l’éthylène 30
4.5.2 Transduction du signal à l’éthylène 31
5 Du zygote à la graine 32
5.1 Embryogénèse : mise en place de l’embryon et des réserves 32
5.2 Dormance et germination, régulation par les hormones et la lumière 32
6 Bases cellulaires et génétiques de la construction d’une plante 33
6.1 Les méristèmes et la mise en place de la structure primaire des racines et des tiges :
contrôle de la division, de l’élongation et de la différenciation 33
6.2 Organisation fonctionnelle des méristèmes racinaires et caulinaires de la cell apicale
aux méristèmes pluricellulaires 33
6.3 Notions de cellules souches et gènes de dvpt 33
6.4 Mise en place, dvpt et sénescence des feuilles 33
6.5 Ramification des systèmes racinaires et caulinaires 33
6.6 Dispositifs de croissance radiale 33
7 Evolution de la reproduction sexuée et morphogénèse florale 33
7.1 Facteurs inducteurs de la floraison 33
7.2 Paramètres structuraux et génétiques de l’induction et du développement floral 33
7.3 Evolution de la reproduction sexuée chez les Embryophytes 33
7.4 Pollinisation, auto-incompatibilité et fécondation 33
7.5 De la fleur au fruit 33
8 Conclusion 33

LV302 – Plantes – Dernière mise à jour 01/10/08
3
1 Introduction
1.1 Rappels
P1
Plantes sup = spermatophytes
Evolution des caractères biologiques
Algues : milieu diff. Contraintes du mil adaptation
Les plantes : tissu soutien, conducteurs, repro « à sec »
Sortie du milieu aquatique vx
Communication cellulaire gaz
Tissus reproducteurs au sommet des tissus végétatifs
Trias : Végétaux supérieurs
Puis plantes à fleurs et à ovules, hermaphrodites et spermatophytes modernes
Endosymbiose photo$
Origine évolutive des plantes à fleurs (angiospermes) converge à un ancêtre. se sont
diversifiées après
P2 Arbre des eucaryotes
Angiosperme (les 2 du bas des Métaphytes)
Il existe d’autres lignées photo$ : algues brunes et vertes (endosymbiose secondaire)
Origine évolutive lignée verte : adaptation terrestre
1.1.1 Dvpt végétal versus dvpt animal
Animal
végétal
- cellule souple
- division animale par pincement
-paroi pectocellulosique (paroi rigide)
- plan de div pré établi, marqué par une
bande de prot (plaque) constituant des
MT = phragmoplaste
- plan de div établie selon orientation, ou
asymétrique
- blastulation (stade morula) :
homogénéité dans les cellules
- dès la première div : div asymétrique
- plan de div TJS le même selon l’espèce
donnée
- définition de 2 pôles : apical (embryon)
et basal (tissu suspenseur)
- les cell animales peuvent régresser au
st. cell souche (mais découverte assez
nouvelle)
- une cell est totipotente (mise au point
avec cell de mésophylle), on peut obtenir
un embryon ou une racine
- permet de sauver les espèces en voie
de disparition
- fonctionnement des méristèmes (cell

LV302 – Plantes – Dernière mise à jour 01/10/08
4
souches) peuvent générer en
permanence des organes durant tout le
long de la vie de la plante
1.1.2 Rappels sur l’anatomie des plantes
- sèves brutes/ élaborée
- connexions entre cellules via APOPLASME (circule à l’ext) et SYMPLASME (circule
à travers les cellules)
- jonctions cellulaires : jonction GAP (p11 fig 15,24)
- Plasmodesme = RE commun à 2 cellules permettant le passage de molécules
- spermaphytes forment les végétaux complexes
1.1.3 Diversité des types biologiques
Il existe deux grands types de plantes à fleurs :
Monocotylédone
Dicotylédone
- embryon à 1 cotylédon
- nervure //
- pas de racine principale
- nb de pétales multiple de 3
- embryon à 2 cotylédons
- nervures ramifiées
- racines latérales et racine principale
(fig 3.40 p6)
≠ types de végétaux se distinguent par le mode de reproduction :
¤ Plantes annuelles :
- cycle de vie entier, meurt dans l’année,
- part de la germination de la graine dvpt de la partie végétative puis mise en
place de la structure de reproduction qui donne 1 fruit/ graine entouré dans les tissus
maternelle qui donnent les fruits
- graine = structure sèche qui permet à la plante de résister (stratégie de survie)
¤ Plantes pérennes
- survivent plusieurs saisons, plusieurs années
- plantes à bulbe, stock la partie végétative sous forme de tissus souterrains
(réserves de molécules riches en énergie)
- la partie aérienne est sacrifiée car sensible au gel
¤ Espèces ligneuses, arbre :
- partie aérienne
- dvpt maintient structure solide qui permet la colonisation dans l’atmosphère de
tissus photo$iques
- en hiver, ils se débarrassent des feuilles
¤ Cryptophytes : espèces qui maintiennent 1 partie aérienne en mauvaise saison,
plante qui se cache

LV302 – Plantes – Dernière mise à jour 01/10/08
5
1.1.4 Cycle de dvpt d’une plante à fleur
POLLINATION
FERTILIZATION ZYGOTE (1 CELL)
EMBRYO DEVELOPMENT
SEED
1.2 La plante : un système intégré en interaction avec son
environnement
1.2.1 Contraintes de la vie fixée : adaptations développementales et
plasticité du végétal
(p 8-9)
• Perception de la lumière (photorécepteurs)
• Perception de l’environnement chimique
• Racines perçoivent des minéraux. ex : nitrate , CO2
• Perception physique
• T°C, vent, force de gravité
Plusieurs expériences : p 5, p12
1.2.2 Tropismes
1.2.3 Systèmes de perception des signaux
1.2.4 Les hormones : nature, métabolisme et effets multifactoriels
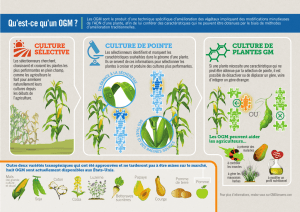
2 Modèle d’études en bio du dvpt des plantes
2.1 Plantes modèles
2.1.1 Antirinium (gueule de loup)
Possède deux atouts :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%