Activité 1 : Quelques longueurs dans l`univers

2nde1 15/12/2006 TPC5
TP Chimie 5 :
Histoire de l’atome
But :
………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………
I) Conception de l’atome dans la Grèce ancienne
La notion d’atome a été formulée pour la première fois par les philosophes de la Grèce ancienne. On l’attribue à
Empédocle, Démocrite, Leucippe et Epicure. Leurs conceptions d’une structure atomique de la matière ne procédaient
pas d’observations ni d’expériences scientifiques, mais d’intuitions.
Leur représentation de l’univers physique était fondée sur l’hypothèse que les corps sont constitués de particules
très légères, invisibles et surtout indivisibles. Ils les appellent atomes ; en grec ancien, le mot atomos (oo)
signifie indivisible.
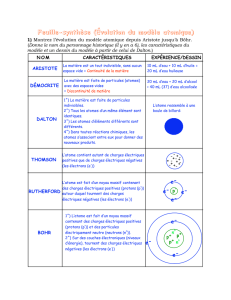
La théorie atomique la plus originale de l'époque fût proposée par Démocrite (IVe siècle av. J.-C.). Ce savant
philosophe proposa d’établir que ce qui est à la base de toute la construction du monde ne peut se subdiviser
indéfiniment. On ne pourrait pas sinon s’en servir comme éléments de construction. En effet, si les atomes pouvaient
être cassés et divisés en parties de plus en plus petites, la nature finirait par perdre toute consistance et ressembler à
une soupe de plus en plus diluée.
Les éléments de construction de la nature devaient d’autre part être éternels, car rien ne naît du néant. Tous les
atomes devaient être solides et massifs sans pour autant être les mêmes. Car si tous les atomes étaient identiques, il
n’y aurait pas d’explication satisfaisante pour rendre compte de la variété des formes des objets de la nature. Il devait
exister une infinité d’atomes dans la nature : des ronds, des lisses, des crochus, des rugueux… Et c’est justement
parce qu’ils avaient des formes différentes qu’ils pouvaient s’assembler en d’infinies variantes. Entre ces atomes
existait un espace vide. La matière était donc discontinue.
Cette "théorie" rencontrera beaucoup de détracteurs au cours des siècles qui vont suivre, notamment au cours du
Moyen Age avec l'apparition de l'Alchimie, science légendaire à l'origine de la chimie moderne.
(1) Par quelle démarche les savants grecs sont-ils parvenus à la notion d’atome ?
(2) Quelles sont les contributions de Démocrite au modèle de l’atome grec ?
(3) Comment l’atome est-il qualifié dans ce modèle ?
(4) Réaliser un schéma des modèles de l’atome de Démocrite.
II) L’atome du XIXe siècle
Ce n’est que deux mille ans après ces énoncés qu’une théorie atomique fut scientifiquement formulée. La théorie
atomique moderne est née des efforts de John Dalton (1766-1844) au début du XIXe siècle pour interpréter les
phénomènes quantitatifs de la chimie. Ce chimiste et physicien britannique arriva à sa théorie atomique par une
étude des propriétés physiques de l'air atmosphérique et des autres gaz. En combinant les idées de Démocrite sur
l’atome et de Lavoisier sur la conservation de la masse, Dalton proposa pour la première fois en 1803 le modèle de
l’atome qui porte son nom.
Il considère que la matière est faite d'atomes et que lors d'une réaction chimique, ces atomes (tous de forme
sphérique pleine et qui ont la propriété d'être insécables) peuvent se combiner avec d'autres atomes. Cette théorie
est la pierre d'angle de la science physique moderne.
Le modèle de John Dalton sera suffisant pour décrire bon nombre de phénomènes chimiques étudiés dans ce
siècle prolifique qui débute, c'est en partie pour cette raison qu'il restera en place durant de nombreuses années.
(5) En quoi la démarche de Dalton est-elle différente de celles des savants grecs ?
(6) En quoi le modèle atomique de Dalton contredit le modèle atomique grec ?
(7) Qu’apporte de plus ce nouveau modèle ?
(8) Réaliser un schéma du modèle de l’atome de Dalton.
III) L’apparition des charges électriques dans l’atome
Jusqu'à la fin du XIXe siècle, la théorie atomique reste une intuition. Il faudra attendre la fin de ce siècle pour que
le développement technologique puisse permettre d'apporter des débuts de preuve à la cohérence mais aussi à
l'incohérence du modèle de Dalton. La notion d’atome comme particule indivisible fut alors mise en doute.
Dans un premier temps, plusieurs expériences sur les décharges électriques dans les gaz amènent le physicien
français Jean Perrin (1870-1942) à postuler l'existence de grains de matière chargés négativement.
Quelques années plus tard, le physicien anglais Joseph Thomson (1856-1940) démontre que ces grains de
matière identifiés par Jean Perrin, et qu'il appelle électrons, sont tous identiques, quel que soit le corps qu'il étudie. La

2nde1 15/12/2006 TPC5
découverte de l'existence des électrons conduit Thomson à proposer en 1902 un nouveau modèle de l'atome à partir
du modèle de Dalton : le plum-pudding (pain aux raisins).
Les électrons sont considérés comme des "raisins" négatifs enfoncés dans un "pain" de matière positive, une
sphère de rayon environ égal à 0,1 nm. Dans un atome neutre, des électrons seraient enclos dans cette sphère, leur
charge totale étant égale à la charge positive de la sphère.
(9) Pourquoi la conception antique de l’atome est-elle contredite par le modèle de Thomson ?
(10) Qu’ont de commun les modèles de Dalton et de Thomson ?
(11) Réaliser un schéma du modèle de l’atome de Thomson.
IV) La structure lacunaire de l’atome
Le modèle de Thomson est révolutionnaire mais dans cette période de découvertes à outrance, il est vite délaissé
à son tour et remplacé par un nouveau modèle, un modèle qui remet en question une hypothèse vieille de plus de
deux mille ans.
En 1911, Ernest Rutherford (1871-1937), un physicien néo-zélandais, poursuit ses travaux sur la structure de la
matière. Il cherche notamment à en savoir plus sur la façon dont les atomes sont placés les uns par rapport aux
autres dans la matière. Pour ceci, il bombarde une fine feuille d'or avec des particules alpha (noyaux d'hélium) de
taille bien plus faible que les atomes d'or. S'attendant à voir les particules rebondir, il est stupéfait de voir que la
plupart de ces particules alpha traversent la feuille d'or, comme si elle était faite de "trous". Seule une infime minorité
de particules alpha (une sur 100 000) semble rebondir sur la feuille d’or, une minorité sont déviées de leur trajectoire
en traversant la feuille mais la grande majorité ne sont pas déviées. Il en tire rapidement une conclusion qui remet en
cause l'idée jusque-là admise que les atomes sont des sphères pleines.
Une théorie révolutionnaire apparaît alors : l'atome est constitué principalement de vide. Rutherford identifie alors
la structure de l’atome à un système planétaire ; l’atome est formé au centre d'un noyau massif chargé positivement
(rôle du Soleil) autour duquel se déplacent les électrons (rôle des planètes).
La théorie de la structure lacunaire (encore appelée théorie nucléaire) de la matière est née.
(12) Quelle idée est remise en cause par le modèle de Rutherford ? Par quelle innovation est-elle
remplacée ?
(13) Sachant que deux particules chargées positivement se repoussent, expliquer pour quelle raison
certaines particules alpha traversent la feuille d’or en étant déviées.
(14) Comment justifier que certaines particules rebondissent sur la feuille d’or ?
(15) Réaliser un schéma du modèle de l’atome de Rutherford.
V) Le modèle orbitalaire
En 1913, un physicien danois du nom de Niels Bohr (1885-1962) complète la théorie du noyau atomique de
Rutherford. Il ébauche un modèle qui portera son nom. Les atomes sont faits de noyaux de taille négligeable face à
celle de l'atome entier, noyaux qui représentent toutefois la quasi-totalité de la masse de l'atome. Autour de ce noyau
se trouve un "cortège" électronique. Les électrons sont situés sur des orbites fixes et se déplacent autour du noyau.
Ces orbites sont appelées couches électroniques et elles ne peuvent comporter qu’un nombre limité d’électrons.
(16) Quelle est la nouveauté apportée par le modèle de Bohr ?
(17) Réaliser un schéma du modèle de l’atome de Bohr.
(18) Comparer les périodes d’apparition des modèles de l’atome. Que remarque-t-on ?
VI) Vers une description quantique
Le modèle de Bohr a la particularité de permettre l'application de la théorie des quanta d'énergie développée par
Max Planck (1858-1947) en 1900 et par Albert Einstein (1879-1955) en 1905. Les électrons peuvent "sauter" d'une
orbite à une autre par gain ou perte d'un quantum d'énergie. C’est l’énergie qui devient la grandeur physique
fondamentale : l’électron n’est pas matériel et il n’a plus de mouvement que l’on puisse représenter.
La description quantique de l’atome qui, à des raffinements près, reste valable depuis le milieu des années trente,
est une description mathématique, impossible à transcrire en images. Cette description est basée sur la probabilité de
présence d’un électron de l’atome en un point de l’espace à un instant donné. Il est impossible de savoir exactement
à la fois où se trouve un électron et où il va comme l’énonce Werner Heisenberg (1901-1976) en 1927. Le cortège
électronique devient alors le nuage électronique dans le modèle décrit par Erwin Schödinger (1887-1961) quelques
mois plus tard.
L’histoire de la théorie quantique montre qu’il faut renoncer à toute possibilité de représentation intuitive.
1
/
2
100%