NOM

Caractéristiques physiques dune espèce chimique
1. Corps purs et mélanges.
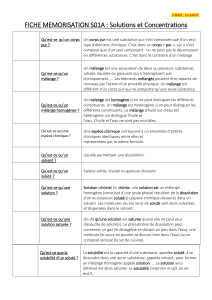
Mélange. Un mélange à structure moléculaire renferme plusieurs sortes de molécules.
Corps pur. Un corps pur à structure moléculaire renferme une seule sorte de molécules.
Corps pur simple. Corps pur dont chaque molécule est constituée d’une seule sorte
d’atomes (O2, N2)
Corps pur composé. Corps pur dont chaque molécule est constituée de plusieurs sortes
d’atomes (H2O, CO2, C6H12).
Composé organique. Un composé organique renferme au moins les éléments C
(carbone) et H (hydrogène). Par exemple, le cyclohexane C6H12, la propanone C3H6O.
Composé inorganique. Tout ce qui n’est pas organique. Une substance inorganique est
encore parfois dite « minérale ». Par exemple H2O ou CO2.
Les caractéristiques d’une espèce chimique
(corps pur) permettent d’identifier cette
espèce.
2. La température de changement d’état.
Ebullition : ___________________________________________________________________
_____________________________________________________________________________
Evaporation : _________________________________________________________________
_____________________________________________________________________________
La température est constante au cours du changement d’état et est indépendante du sens de la
transformation.
Température de fusion : F Température d’ébullition : E en degrés Celsius (°C)
Remarques.
1. La température d’ébullition d’un corps dépend sensiblement de la pression. Les tables donnent
la température normale d’ébullition (température d’ébullition sous pression atmosphérique
normale). Température normale d’ébullition de l’eau : 100°C.
2. La température de fusion se mesure à l’aide d’un banc Koffler., la température d’ébullition à
l’aide d’un thermomètre. Température de fusion de l’eau : 0°C.
Exercice numéro 10 page 210.
Solide
Liquide
Liquide
Gaz (vapeur)

3. Masse volumique. Densité.
3.1. Masse volumique.
La masse volumique
d’une espèce chimique est le quotient constant (dans les mêmes
conditions de température et de pression) de la masse d’un corps par son volume.
3.2. Densité d’un solide ou d’un liquide par rapport à l’eau.
La densité d d’une espèce chimique, solide ou liquide, par rapport à l’eau, est le quotient de la
masse m d’un certain volume de cette espèce chimique par la masse du même volume d’eau (pris
dans les mêmes conditions de température et de pression).
En particulier, c’est le quotient de la masse volumique de l’espèce par la masse volumique du
même volume d’eau.
Exercice numéro 11 et 12 page 210.
3. Solubilité.
Soluté. Solide, liquide ou gaz dissous dans un solvant pour en réaliser une solution.
Solvant. Liquide permettant la dissolution du soluté.
Solution. Mélange homogène obtenu par dissolution du soluté dans le solvant.
Dissolution. Action de dissoudre une substance dans un solvant.
Solution saturée. Solution telle que la masse de substance que l’on peut dissoudre a atteint sa
valeur maximale : on a atteint la limite de solubilité.
Solubilité. Capacité plus ou moins grande d’une substance à se dissoudre dans un solvant donné.
Par exemple la solubilité du chlorure de sodium dans l’eau à 20°C est voisine de 250 g.L-1.
D’une manière générale, les composés organiques sont solubles dans les solvants organiques et
peu solubles dans les solvants inorganiques, en particulier dans l’eau.
Mélange homogène. Mélange présentant les mêmes propriétés en tout point (une seule phase).
Mélange hétérogène. Un mélange hétérogène présente plusieurs phases.
Phase. Chacune des fractions homogènes d’un mélange hétérogène.
Miscibles. Deux liquides miscibles forment en général un mélange homogène, deux liquides non
miscibles forment un mélange hétérogène.
Emulsion. Liquide trouble obtenu par agitation d’un mélange hétérogène.
Suspension. Une émulsion est constituée de fines gouttelettes de chacun des deux liquides non
miscibles dispersées dans l’autre.
Lire attentivement le livre pages 190 à 193. Savoir faire un schéma annoté de l’ampoule à
décanter et nommer les éléments du montage d’hydrodistillation.
Exercice numéro 11 page 196.
1
/
2
100%