Cycle : Secondaire Année scolaire: 2013

- 1 -
Cycle : Secondaire
Année scolaire: 2013-2014
corrige
Matière: SV
Nom: ___________________
N°: ________ Classe:3 AS B
Date: examen final
Durée : 3 heures
Question I
1. Analyse et validation
3 jours après l’injection de l’antigène, le nombre de plasmocytes commence à augmenter pour atteindre 105
plasmocytes par 108 cellules de rate au 7e jour, puis ce nombre diminue rapidement pour s’annuler au 14e
jour.
Alors que le taux d’anticorps, nul au 7e jour, augmente jusqu’à un maximum de 10 u.a au 17e jour puis chute
jusqu’à s’annuler au 25e jour.
Ceci montre que les plasmocytes apparaissent 3 jours après l’injection de l’antigène et les anticorps
circulants 4 jours après l’apparition des plasmocytes et leur taux évolue pratiquement comme celui des
plasmocytes.
Le fait que les anticorps apparaissent 4 jours après les plasmocytes suggère que ces molécules sont sécrétées
par les plasmocytes ; leur disparition parallèlement à celle des plasmocytes en est une confirmation. Ce qui
valide l’hypothèse.
2. Représentation schématique
3. Analyse et nature des cellules
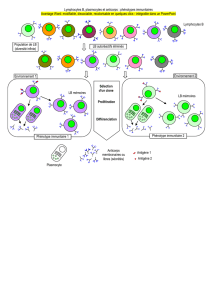
Dans le milieu contenant des macrophages, des lymphocytes T et des lymphocytes B avec le bacille du
tétanos toujours présent (milieu 4) ou éliminé par lavage (milieu 6), le taux d’anticorps est maximal (100%)
tandis que ce taux est nul dans le milieu contenant le bacille avec seulement des macrophages (milieu 1), ou
très faible dans le milieu contenant le bacille du tétanos avec des lymphocytes B seulement (10% dans le
milieu 2) ou les lymphocytes B et T (15% dans le milieu 3).
Ceci montre que la sécrétion d’anticorps nécessite les macrophages (placés en contact avec le bacille), les
lymphocytes T et les lymphocytes B.
4. Rôle des cellules
Les macrophages, ayant phagocytés l’antigène, deviennent des cellules présentatrices de l’antigène aux
lymphocytes T4. Les LT4 ainsi activés sécrètent des interleukines qui activent les lymphocytes B.
Les lymphocytes B ayant reconnu l’antigène, se différencient en plasmocytes qui produisent les anticorps
circulants.
Milieu 1
Milieu 4
Milieu 5
Milieu 2
Milieu 3
Milieu 6
1 h après:
Lavage
Titre: schéma du protocole expérimental
Milieu de culture
Lymphocyte T
Lymphocyte B
Macrophage
Bacille du tétanos

- 2 -
Question II
1. Analyse et différences.
Les graphes 1 repésentent l’évolution des taux de progestérone, d’oesradiol, de LH et de FSH chez Madame E.
Le taux de progestérone est presque nul pendant les 14 premiers jours. Au cours de la deuxième moitié du cycle,
du J15 à J28, ce taux augmente à partir du 14e jour et fluctue autour de 5 ng.mL-1.
Le taux d’oestradiol fluctue autour de 100 pg.mL-1 jusqu’au 9e jour puis augmente progressivement jusqu’à 300
pg.mL-1 au 15e jour avant de diminuer rapidement jusqu’à 100 pg.mL-1 au 16e jour. De J16 à J28, ce taux fluctue
entre 100 et 130 pg.mL-1.
Le taux de FSH est de 3 mUI.mL-1 et celui de LH est de 5 mUI.mL-1 à J4. De J4 à J14, le taux de FSH reste à
peu près constant de 3 mUI.mL-1 et le taux de LH augmente lentement jusqu’à 10 mUI.mL-1. De J14 à J15, les
deux taux augmentent rapidement jusqu’à 10 mUI.mL-1 environ pour la FSH et 15 mUI.mL-1 pour la LH. A
partir de J15, les deux taux diminuent jusqu’à 3 mUI.mL-1 pour la FSH et 15 mUI.mL-1 pour la LH à J17 puis ils
fluctuent autour des ces valeurs jusqu’à J26.
Comparés à ceux de la femme fertile, les dosages hormonaux effectués chez Madame E montrent les différences
suivantes :
Pour la progestérone, une sécrétion faible de J14 à J28 avec nottament l’absence de la décharge observée au
21e jour chez la femme fertile.
Pour l’oestradiol, un taux global plus faible, avec un taux maximal de 300 pg.mL-1 observé au 15e jour au lieu
d’un taux maximal d’environ 500 pg.mL-1 observé à J14. On note aussi l’absence d’une décharge à J21.
Pour la FSH et la LH, la sécrétion est globalement faible chez Madame E avec pratiquement absence de pic au
15e jour.
2. Anomalies de Madame E.
Le faible taux d’oestradiol au début du cycle montre qu’il n’y a pas de croissance folliculaire chez Madame E.
L’absence, d’une part, de la décharge d’oestradiol au 14e jour et, d’autre part, de pic de LH, montre que
l’ovulation ne se produit pas chez Madame E. Le faible taux de progestérone au cours de la 2e moitié du cycle
confirme cette conclusion.
Comme le taux de FSH et celui de LH sont faibles, on peut penser que les ovaires ne sont pas (au moins
convenablement) stimulés par l’hypophyse.
3. Analyse et déduction.
Avant la lésion sélective de la région postérieure de l’hypothalamus, le taux de FSH fluctue autour de 350 μg.L-1.
Après la lésion (j0), le taux chute, d’abord rapidement pour atteindre 50 μg.L-1 en 2 jours, puis lentement pour
pratiquement s’annuler au 6e jour.
Avant la lésion sélective de la région postérieure de l’hypothalamus, le taux de LH fluctue autour de 30 μg.L-1.
Après la lésion (j0), le taux chute rapidement pour pratiquement s’annuler en 1 jour.
On peut donc déduire que la lésion hypothalamique inhibe (bloque) la sécrétion de LH et de FSH.
4. Hypothèse.
Les anomalies responsables de la stérilité de Madame E sont dues à un mal fonctionnement de la région
postérieure de son hypothalamus.
5. Effets recherchés.
Les injections quotidiennes de FSH ont pour but la stimulation de la croissance et du développement des
follicules ovariens.
L’injection d’une forte dose de LH sert à déclencher l’ovulation.
6. Explication.
L’examen échographique montre la présence de deux follicules ovariens mûrs. Il y a eu donc développement
folliculaire.
On peut aussi supposer que la LH injectée a bien induit l’ovulation de ces deux follicules mûrs.
Fécondés par deux spermatozoïdes, ces follicules ont donné deux cellules-œufs à l’origine des deux jumeaux de
Madame E.

- 3 -
Question III
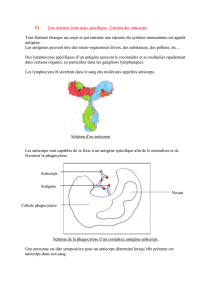
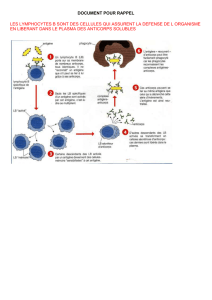
1. Origine des anticorps circulants.
Les anticorps circulants sont produits par les plasmocytes provenant de la différenciation des LB activés.
2. Comparaison.
L’enfant malade ne possède aucun lymphocyte T alors que l’enfant non malade en possède entre 2000 et
4000 LT par μL.
Cet enfant malade possède 1250 LB par μL, concentration comprise entre celles de l’enfant non malade (de
1000 à 2000 LB par μL).
La caoncentration des anticorps circulants de l’enfant malade est nulle alors qu’elle est supérieure à 400
mg/dL chez l’enfant non malade.
3. Explication.
Les anticorps sont produits par des plasmocytes. Ces derniers résultent de la différenciation des LB activés.
Or l’activation des LB a lieu après reconnaissance de l’antigène mais aussi sous l’effet des interleukines
sécrétées par les LT4 ayant reconnu l’antigène présenté par la CPA.
Les mesures chez l’enfant malade montrent une absence totale des LT, y compris les LT4 nécessaires à
l’activation des LB.
4. Hypothèse.
Le déficit immunitaire de l’enfant peut être lié au manque de lymphocytes T.
5. Analyse.
Au 15e jour après la thérapie, le nombre de LT dans le sang du malade traité est de 200 LT/μL. Ce nombre
augmente jusqu’à 1 800 LT/µL au bout de 175 jours et se stabilise à cette valeur jusqu’au 240e jour. Ce
nombre raugmente rapidement jusqu’à 3000 LT/µL au 270e jour.
6. Elimination du déficit.
Le graphique montre que le nombre de LT dans le sang du malade traité a augmenté rapidement après le
traitement, atteignant le taux de 1800 au bout des six premiers mois. Ceci correspond à un nombre total de
LT égal à 9.109 pour les 5 litres de sang alors que 108 cellules transformées ont été injectées.
Les LT se sont donc différenciés et multipliés. En conséquence, le déficit immunitaire en LT est éliminé.
7. Restauration de la réponse immunitaire.
Chez l’enfant malade, L’immunité cellulaire comme l’immunité humorale sont absentes puisqu’il n’y a pas
de lymphocytes T et pas d’anticorps. La présence de LB à une concentration normale montre que l’absence
d’immunité humorale est due à l’absence de LT4, lymphocytes auxiliaires nécessaires à l’activation des
LB. L’immunité cellulaire, qui nécessite également des LT4, est aussi privée de cellules effectrices, les
LT8 ou LT cytotoxiques.
Le document 3 montre que le traitement a été efficace et a restauré une immunité normale. En effet, la
concentration en anticorps chez l’enfant traité atteint 323 mg.dL-1 six mois après le traitement, à peine
inférieur au taux d’anticorps chez un enfant qui en a toujours fabriqué (> 400 mg.dL-1, document 1). En
outre, à la suite de deux vaccinations différentes, le taux d’anticorps atteint des valeurs (0,53 et 0,86) très
élevées (>> 0,20) montrant que les LT se sont multipliés chez l’enfant malade et sont capables de stimuler
fortement la production d’anticorps.
Ceci explique les niveaux quasi normaux d’anticorps mesurés et montre qu’il existe de nouveau une
réponse aux antigènes de l’environnement. En outre, après les vaccinations, le nombre de LT augmente
encore pour atteindre une valeur physiologique (3 100/µL). Ceci montre que des réponses spécifiques avec
production de LT et d’anticorps se développent après les stimulations vaccinales. Ainsi, la restauration du
système immunitaire a réussi au moins pour les réponses humorales (LT4, LB). Si les LT sont restaurés, il
y de fortes chances que les réponses cellulaires soient restaurées également puisque, outre les LT4, elles
mettent en jeu d’autres LT, les LT8.

- 4 -
Question 4
1- Dans la premiere partie du document 1 lors de l’injection de l’insuline a la 30eme minutes, la
glycemie qui était de 1g/L diminue jusqu'à 0,5 g/L a la 60eme minutes et dans la 2eme partie
du document suite a l’injection du glucagon a la 2eme heure la glycemie augmente de 1g/L
pour atteindre une valeur superieure a 2g/L. on peut donc deduire que l’insuline est une
hormone hypoglycemiante et que le glucagon est une hormone hyperglycemiante.
2- D’apres le document 2 on remarque que la glycemie augmente suite a n’importe quel repas
car l’apport du glucose ne peut avoir qu’une origine alimentaire et que tous les aliments
contiennent du glucose. La glycemie diminue suite a une activite physique car cette activite a
besoin d’energie qui ne peut etre obtenue que par la degradation du glucose en presence du
dioxygene.
3- Le foie joue un role dans la regulation de la glycemie dans les deux sens. En cas
d’hyperglycemie il favorise la glycogenese en mettant l’exces de glucose sous forme de
glycogene dans le fois ou en le transformant en lipides pour le mettre dans le tissu adipeux
(lipogenese). Dans le cas d’une hypoglycemie le foie favorise la glycogenolyse pour degrader
la glycogene en glucose et le donner au sang. En cas de besoin le corps utilise la
neoglucogenese ou la lipolyse pour assurer le glucose a partir des acides amines ou des
lipides.
1
/
4
100%