Préparation de la solution antiseptique

SAÉ adaptée par Phylippe Laurendeau, CS des Samares, à partir d’une production du Centre de développement
pédagogique, 2010.
1
Partie 1 et 2
Guide du personnel enseignant et technique
Solution
antiseptique

SAÉ adaptée par Phylippe Laurendeau, CS des Samares, à partir d’une production du Centre de développement
pédagogique, 2010.
2
Réalisation
-Centre de développement pédagogique, 2010.
-Adaptation par Phylippe Laurendeau, conseiller pédagogique, Commission scolaire des
Samares, 2011.
Description de la SAÉ :
Cette situation d’apprentissage a été développée pour le cours Applications technologiques et
scientifiques de la 3e année du secondaire. Elle a été adaptée pour Science et technologie. On y
retrouve plusieurs activités d’acquisition de ressources (laboratoires, capsules théoriques,
rappels, exercices, etc.) et se termine par deux tâches complexes : l’élaboration d’une solution
d’alcool et la conception d’un distributeur de solution antiseptique.
Cette situation d’apprentissage et d’évaluation permet à l’élève de bien comprendre les
concepts liés aux propriétés des solutions. Dans un premier temps, une démarche expérimentale
amènera l’élève à préparer une solution antiseptique d’une concentration donnée. Par la suite,
une démarche de conception permettra à l’élève de mettre au point un distributeur de solution
sans contact contrôlé par un circuit électrique simple.
La deuxième partie met surtout en jeu les concepts de leviers vus au 1er cycle. Il n’est pas mal
de les réutiliser en 3e secondaire. Il s’agit d’une conception simple et courte qui ne nécessite
pas l’utilisation des machines-outils ni la présence en atelier. De plus, bien que l’ingénierie
électrique ne fasse pas partie des concepts à l’étude en Science et technologie de 3e secondaire,
on pourra insister sur la conception d’un mécanisme interrupteur et soutenir les élèves dans le
branchement du circuit électrique qui est vraiment très simple.
L’effecteur est composé d’un simple ressort de nitinol. Ce matériau technologique est fait d’un
métal non-ferreux qui reprend sa forme initiale lorsque chauffé à une température critique.
Ainsi, le ressort étiré reprenant sa forme initiale, il peut appliquer une force et effectuer un
travail. De l’information utile sur le nitinol se trouve dans l’activité 3.
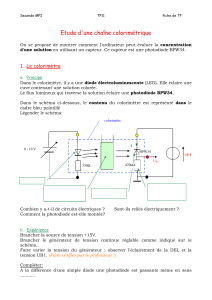
Les techniques suivantes sont touchées : préparation d’une solution, utilisation d’un instrument
de mesure, schématisation, montage et démontage.
En ATS, on pourra exploiter davantage l’ingénierie électrique liée au circuit qui alimente le fil
de nitinol.

SAÉ adaptée par Phylippe Laurendeau, CS des Samares, à partir d’une production du Centre de développement
pédagogique, 2010.
3
CONTENU DE FORMATION
Univers matériel
Organisation de la matière
Mélanges homogènes (solutions) et hétérogènes
Transformation de la matière
Transformation physique (dissolution et dilution)
Modèle particulaire (solution saturée)
Propriétés de la matière
Propriétés des solutions (soluté, solvant, solution, concentration, préparation
d’une solution)
Univers technologique :
Matériaux
Types de matériaux et ses propriétés (alliages non ferreux : nitinol)
Propriétés mécaniques (caractéristiques de la structure du nitinol)
Contraintes (traction)
Ingénierie mécanique
Fonctions types (liaison, guidage)
Liaisons types des pièces mécaniques (directe ou indirecte, rigide ou élastique,
démontable ou indémontable, complète ou partielle)
Langage des lignes
Forme de représentation (croquis)
Standards et représentations

SAÉ adaptée par Phylippe Laurendeau, CS des Samares, à partir d’une production du Centre de développement pédagogique, 2010.
4
REPÈRES CULTURELS POSSIBLES
Les épidémies qui frappent à l’occasion nos sociétés sont de bons repères culturels. La
pandémie de grippe AH1N1 vécue en 2009 a sans doute marqué nos élèves. Lors de cette
pandémie, les distributeurs de solutions antiseptiques n’ont jamais été aussi présents
dans notre entourage. Cette SAE peut être l’occasion de faire le point sur l’efficacité de
l’utilisation de telles solutions.
Axe de développement : Connaissance des conséquences de ses choix personnels sur
sa santé et son bien-être.
Ici, c’est la connaissance des principes élémentaires d’hygiène et de santé qui est
visée. Il s’agit simplement de prendre conscience que de mauvaises habitudes
peuvent mener à l’ingestion de microorganismes pathogènes. Se laver les mains avant
d’ingérer de la nourriture, utiliser des solutions antiseptiques et tousser dans son
coude sont des exemples de bons comportements à mettre de l’avant.

SAÉ adaptée par Phylippe Laurendeau, CS des Samares, à partir d’une production du Centre de développement pédagogique, 2010.
5
PRÉPARATION
Mise en situation :
L’enseignante ou l’enseignant pourrait initier une discussion sur un des sujets suivants :
-la pandémie de la grippe H1N1 et autres pandémie à travers l’histoire.
-la prolifération des bactéries (mode de transmission, vitesse de division cellulaire, etc)
-l’apparition de distributeurs de solution antiseptique dans les édifices publiques
-la composition des solutions antiseptiques et leur efficacité réelle
-les types de distributeurs
Voici des capsules vidéo suggérées :
http://www.youtube.com/watch?v=tJ2KhU3z2MM&NR=1
http://www.youtube.com/watch?v=gEwzDydciWc&feature=PlayList&p=54C80DA513D0D9B2&index=0
http://www.youtube.com/watch?v=B29h_7F3rz0
http://www.youtube.com/watch?v=Hbyy5lRbGZw
Mandat :
Il faut s’assurer que les deux mandats de la tâche (produire une solution antiseptique et concevoir une
machine distributrice) soient bien compris pas les élèves. Un retour en grand groupe pourrait être
nécessaire pour s’assurer de la compréhension de tous les élèves.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%