Céline Leroy Laure Le Coadou 17/02/2011 EC immuno dépression

1/11
Céline Leroy
Laure Le Coadou
17/02/2011
EC immuno dépression, défense antibactérienne et immunité innée, Samer Kayal
Le poly sera disponible sur l’ENT
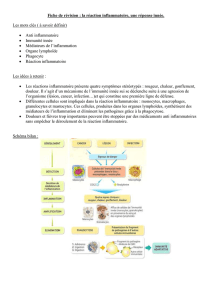
Défenses antibactériennes et immunité innée
I- Définitions générales
Il existe différentes immunodépressions :
- Immunodépressions induites (corticothérapies..)
- Immunodépressions acquises
1) Rappel sur les bactéries
Il y a différents types de bactéries. On définit ainsi
Les bactéries saprophytes qui vivent et se nourrissent dans l'environnement. Elles ne sont pas en
commensalisme avec nous mais peuvent devenir pathogènes.
Les bactéries commensales vivent au contact du revêtement cutanéo-muqueux sans entrainer de
désordres. Elles peuvent par contre devenir pathogènes si il y a un déficit de l'immunité.
Les bactéries pathogènes :
- Elles sont capables d’induire une lésion tissulaire chez l'hôte. Elles sont pathogènes chez tout
le monde mais cette pathogénicité est + forte en cas de déficit immunitaire.
- Pathogénicité : la notion de dose infectante est importante pour connaitre la pathogénicité
d’une bactérie. Par exemple, une seule bactérie de type Yersina pestis suffit pour entrainer la
peste.
La pathogénicité se traduit par la capacité à induire une lésion chez l’hôte.
- Virulence et facteurs de virulence
Les bactéries opportunistes : elles sont généralement non pathogènes chez le sujet sain mais
peuvent devenir pathogènes chez l’hôte fragilisé et immunodéprimé.
Elles peuvent être saprophytes ou bien commensales:
- Saprophytes : Pseudomonas aeruginosa , Staphylococcus aureus, certaines entérobactéries
(Klebsielle, enterobacter, Serratia)
- Commensales : Les Entérocoques, E. coli, S. epidermitis

2/11
2) La rencontre de la bactérie avec son hôte
Le commensalisme :
- Bactéries inféodées au revêtement cutanéo muqueux (peau, cavité buccale, dentaire,
intestinale, vaginal, urétral…) : les bactéries rencontrées diffèrent selon la localisation.
- La flore commensale est variable en fonction de l’age, de l’alimentation, de la santé, de la
prise d’antibiotique… Dès la naissance, l’homme est entouré de bactéries et doit apprendre à
se défendre et à vivre avec.
- Cette flore commensale est une barrière écologique contre l’implantation de germes virulents.
- Il y a un équilibre entre la flore et l’hôte.
La maladie infectieuse :
Elle résulte d’un conflit entre l’hôte et le pathogène qui aboutit à une lésion tissulaire. L’hôte met
en place des réactions de défense non spécifique et spécifique. L’évolution favorable correspond à
la guérison (avec ou sans séquelles).
La réaction induite va dépendre de la bactérie.
3) Stratégies de défense de l’hôte contre les pathogènes
L’hôte a des mécanismes de défense pour résister aux infections.
Il existe des barrières non spécifiques et spécifiques
Les barrières non spécifiques : ces barrières non spécifiques sont très efficaces et présentes chez
presque tous les pluricellulaires.
- Peau et muqueuse : revêtement épithélial cutané et les muqueuses (nasopharyngée, orale,
respiratoire, intestinale, urogénitale…)
- Barrière mécanique : jonctions serrées, mouvements, cils bronchiques, urines… Ces barrières
mécaniques sont très efficaces au niveau du placenta et du cerveau.
- Barrière chimique : acides gras, enzymes, pH, peptides antimicrobiens
- Barrière microbiennes : flore commensale (par compétition avec la flore pathogène)
Barrières spécifiques :
Elles comprennent un système de reconnaissance non adaptatif. C’est l’immunité innée : elle agit dans les
minutes qui suivent l’agression par le pathogène. Elle permet d’activer un système antimicrobien efficace
et spécifique : l’immunité acquise. Cette immunité spécifique comprend entre autres les anticorps et les
lymphocytes spécifiques d’un antigène

3/11
4) Défense antibactérienne
Pour que la défense antibactérienne soit efficace, l’hôte doit :
- Détecter le caractère invasif de la bactérie afin d’initier l’inflammation ;
Suite à une lésion du tissu (qui peut être infecté ou pas) on peut avoir un pathogène dans le tissu
conjonctif, on a alors un non soi infectieux. Le premier stade est la reconnaissance que quelque chose ne
va pas.
Les cellules endothéliales ont également un rôle central dans la phase initiale de l’inflammation.
- Reconnaitre la bactérie et assurer la défense adéquate. Ceci se fait grâce :
• aux leucocytes : phagocytose
• complément : système immunitaire primitif (ancien)
• protéines de la phase aigüe de l’inflammation qui sont sécrétées par les cellules présentes sur le site
de l’inflammation
- Disposer de mécanismes antibactériens efficaces
Tuer la bactérie peut ne pas être suffisant. C’est le cas dans le botulisme ou la toxine est responsable des
symptômes et devra être détruite par l’intermédiaire des anticorps. Dans ce cas l’immunité innée est
insuffisante.
Il en est de même dans le choc endotoxinique qui peut conduire à un purpura fulminans. L’immunité
acquise est alors indispensable.
L’immunité innée induit la préparation de l’immunité acquise.
- Mettre en place un système spécifique et rapidement efficace lors de prochaine infection par ce même
pathogène : c’est la mémoire immunologique.
Ceci concerne l’immunité acquise cellulaire (lymphocyte T) et humorale (Lymphocyte B)
Rmq : on ne sait pas pourquoi la bactérie passe d’un état commensal à un état invasif.
Résumé :
L’immunité innée :
- La plus ancienne en terme d’évolution. (très antérieure à l’IA) : elle est retrouvée chez les
organismes multicellulaires (plantes, insectes, invertébrés et vertébrés)
- Elle est présente et efficace dès la naissance.
- Elle est immédiatement efficace : 0-4h
- Sans mémoire (non amplifiée lors d’une seconde exposition au pathogène)
- Non spécifique d’un antigène : reconnait des motifs moléculaires bactériens
- Induction de l’inflammation (capable d’induire une réaction inflammatoire intense)
- Essentielle à la mise en place de l’immunité acquise.

4/11
L’immunité acquise :
- Est impliquée dans les processus de vaccination
- La plus récente (vertébrés supérieurs)
- Retardée : quelques jours (15 jours pour la sécrétion d’anticorps)
- Douée de mémoire spécifique d’antigène : une fois que l’ag a été vu, on a une mémoire
immunologique spécifique contre cette ag.
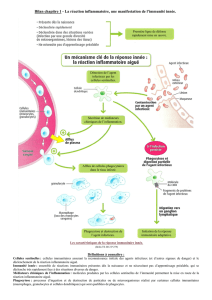
5) Immunité innée et réaction inflammatoire
L’immunité innée initie donc la réaction inflammatoire.
• réaction à la lésion ou à l’infection :
- Trauma tissulaire ou cellulaire
- Présence de matériel étranger (self vs non self)
- Agents infectieux ( « non soi infectieux »)
• induit la sécrétion de molécules effectrices
• mobilise des cellules au site d’infection (polynucléaires, phagocytes)
Exemple : rupture de la peau par une piqure avec entrée de bactéries dans l’organisme. Il y a un signal
émis par la bactérie (« je suis une bactérie ! ») ou par l’organisme (« il y a une bactérie ! »). Ce signal va
entrainer une vasodilatation, stimuler les cellules endothéliales (expression de protéines d’adhésion,
ouverture des jonctions serrées…). Dans le tissu conjonctif on a également les macrophages qui vont
sécréter des cytokines :
- IL1 : stimule endothélium, active les molécules d’adhésion
- IL8 (chimiokines) : active les PN
Ceci va permettre de recruter les cellules effectrices de l’inflammation (PN+++). Les polynucléaires
arrivent au site inflammatoire par la circulation sanguine. Ils roulent puis s’arrêtent en interagissant avec
les cellules endothéliales, et pénètrent dans le tissu conjonctif.
Les participants à cette réponse inflammatoire sont donc
- Les protéines plasmatiques (compléments…)
- Leucocytes et facteurs sécrétés (cytokines)
- Vaisseaux sanguins : cellules endothéliales
L’inflammation entraine une douleur due à la sécrétion de bradykinine et une impotence fonctionnelle.

5/11
6) Coopération Immunité innée – Immunité acquise
L’II va induire l’IA : elle induit une signalisation pour la mise en place et la régulation d’une réponse
adaptative.
2 phénomènes se mettent en place :
• Les cellules macrophagiques sont des cellules présentatrices d'antigènes (=CPA). A partir du
moment où il y a une induction de l'inflammation, elles vont exprimer certaines molécules comme :
- la famille des récepteurs B7 (CD80/CD86…) : permet de recruter de d’activer le lymphocyte
- la famille de récepteurs au TNF pour favoriser l'interaction entre les CPA et les lymphocytes
• Il va y avoir une sécrétion de cytokines (IL12, IL23, IL4) et de chimiokines qui diffère selon le
type de l’infection (profil de sécrétion adapté pour avoir une réponse efficace).
En résumé : les différentes phases de la réponse immunitaire :
- Immédiate (0-4h) : reconnaissance par des récepteurs spécifiques et destruction de la bactérie (par
exemple par le complément)
- Early induced (dans la journée) : cette phase nécessite la sécrétion de protéines par les cellules de
l’inflammation : recrutement de cellules effectrices, reconnaissance et destruction.
- Réponse adaptative (pas développée) : spécificité vis-à-vis de l’antigène et mémoire.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%