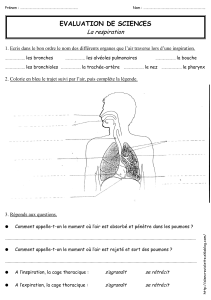
La spirométrie en cabinet

683
CABINET
La spirométrie en cabinet
Markus Gnädingera, Monika Curschellasb, Nadja Nattererc, Robert Thurnheerc
a Institut für Hausarztmedizin und Versorgungsforschung, Universität, Zürich
b Medizinisches Zentrum gleis d AG, Chur
c Medizinische Diagnostik, Kantonsspital, Münsterlingen
Introduction
Valeur de mesure de la spirométrie
Indications de la spirométrie
Quintessence
Abréviations
Forum Med Suisse 2014;14(37):683–688

CABINET
Forum Med Suisse 2014;14(37):683–688 684
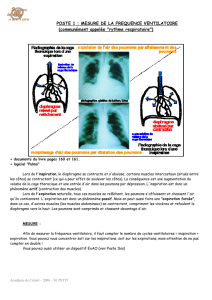
Manipulation de l’appareil
Instructions aux patients,
réalisation de l’examen
vocal cord dysfunction
[s]
[L]
2 3 4 6
1
1
0
2
3
4
5
0 Durée de l'expiration
FVC
5
FEV1
Figure 1
Volume [L]
Expiration
Débit [L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
FEV1
PEF
FVC
Figure 2
Volume [L]
Expiration
Débit [L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2 FVC
FEF50 %
FEF75 %
FEF25 %
FEV1
Figure 3

CABINET
Forum Med Suisse 2014;14(37):683–688 685
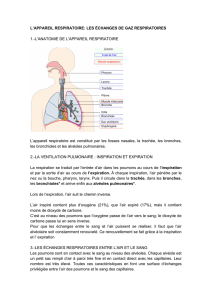
Interprétation des résultats des mesures
Artefact de toux
4
6
8
10
0
2
1
0 3 2 4 5 6 2
[L/s]
[L]
A
Interruption prématurée
4
6
8
10
0
2
1
0 3 2 4 5 6 2
[L/s]
[L]
B
Démarrage différé
4
6
8
10
0
2
1
0 3 2 4 5 6 2
[L/s]
[L]
C
Non reproductible
4
6
8
10
0
2
1
0 3 2 4 5 6 2
[L/s]
[L]
D
Figure 4
A
B
C
D

CABINET
Forum Med Suisse 2014;14(37):683–688 686
Figure 5
AE
BF
CG
DH
Volume [L]
Expiration
Débit[L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
A
Volume [L]
Expiration
Débit[L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
Exp
ir
at
io
n
1
0
0
3
2
4
5
2
2
2
2
B
Volume [L]
Expiration
Débit[L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
C
Volume [L]
Expiration
Débit[L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
D
Volume [L]
Expiration
Débit[L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
1
0
0
3
2
4
5
2
2
2
2
E
Volume [L]
Expiration
Débit[L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
F
Volume [L]
Expiration
Débit[L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
H
Volume [L]
Expiration
Débit[L/s]
Inspiration
4
4
6
8
10
0
6
2
2 1
0 3 2 4 5 6 2
G

CABINET
Forum Med Suisse 2014;14(37):683–688 687
signicative
et
slow vital capacity
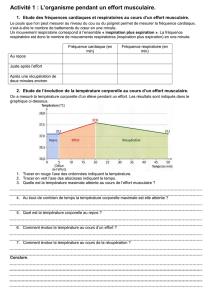
Evaluation
Ta bleau 1
Acceptabilité
Reproductibilité
 6
6
1
/
6
100%