Onglyza, INN-saxagliptin - EMA

7 Westferry Circus ● Canary Wharf ● London E14 4HB ● United Kingdom
An agency of the European Union
Telephone
+44 (0)20 7418 8400
Facsimile
+44 (0)20 7418 8416
E-mail
[email protected]uropa.eu
Website
www.ema.europa.eu
© European Medicines Agency, 2013. Reproduction is authorised provided the source is acknowledged.
EMA/441132/2013
EMEA/H/C/001039
Résumé EPAR à l’intention du public
Onglyza
saxagliptine
Le présent document est un résumé du rapport européen public d'évaluation (EPAR) relatif à Onglyza.
Il explique de quelle manière l’évaluation du médicament à laquelle le comité des médicaments à
usage humain (CHMP) a procédé l’a conduit à rendre un avis favorable à l'octroi d'une autorisation de
mise sur le marché et à établir ses recommandations relatives aux conditions d’utilisation d’Onglyza.
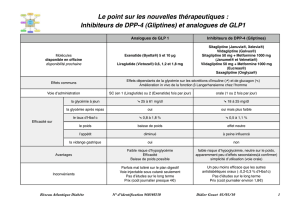
Qu’est-ce qu’Onglyza?
Onglyza est un médicament contenant le principe actif saxagliptine. Il est disponible sous la forme de
comprimés (2,5 mg et 5 mg).
Dans quel cas Onglyza est-il utilisé?
Onglyza est utilisé chez les adultes souffrant de diabète de type 2 afin de contrôler leur taux de
glucose (sucre) dans le sang. Il est utilisé en monothérapie, associé à un régime alimentaire et à la
pratique d’un exercice physique, chez des patients auxquels la metformine ne peut pas être
administrée et dont les taux de glucose ne sont pas contrôlés de manière adéquate par un régime
alimentaire et la pratique d’un exercice seuls. Il est également utilisé en complément d’un régime
alimentaire et de la pratique d’un exercice physique avec d’autres médicaments antidiabétiques,
comme suit:
• avec la metformine chez les patients dont les taux de glucose ne sont pas contrôlés de manière
satisfaisante par la metformine;
• avec un sulfamide hypoglycémiant chez les patients dont les taux de glucose ne sont pas contrôlés
de manière satisfaisante par le sulfamide hypoglycémiant et chez lesquels un traitement à base de
metformine n’est pas considéré comme indiqué;
• avec une thiazolidinedione chez les patients dont les taux de glucose ne sont pas contrôlés de
manière satisfaisante par la thiazolidinedione;

Onglyza
EMA/441132/2013
Page 2/4
• avec de l’insuline (avec ou sans metformine) chez les patients dont les taux de glucose ne sont pas
contrôlés de manière satisfaisante par l’insuline (avec ou sans metformine);
• avec la metformine et un sulfamide hypoglycémiant chez les patients dont les taux de glucose ne
sont pas contrôlés de manière satisfaisante par le traitement combiné de metformine et de
sulfamide hypoglycémiant.
Le médicament n’est délivré que sur ordonnance.
Comment Onglyza est-il utilisé?
La dose recommandée d’Onglyza est de 5 mg une fois par jour, à toute heure de la journée. La dose
d’Onglyza doit être réduite à 2,5 mg une fois par jour chez les patients souffrant de problèmes rénaux
modérés à graves. Si elle est prise en combinaison avec de l’insuline ou un sulfamide hypoglycémiant,
il peut s’avérer nécessaire de diminuer la dose de ces médicaments pour réduire le risque
d’hypoglycémie (faibles taux de sucre dans le sang).
Comment Onglyza agit-il?
Le diabète de type 2 est une maladie dans laquelle le pancréas ne produit pas suffisamment d’insuline
pour contrôler le taux de glucose dans le sang ou dans laquelle le corps est incapable d’utiliser
l’insuline efficacement. Le principe actif d’Onglyza, la saxagliptine, est un inhibiteur de la dipeptidyl
peptidase 4 (DPP -4). Il agit en bloquant la dégradation des hormones «incrétines» dans le corps. Ces
hormones sont libérées après un repas et stimulent la production d’insuline par le pancréas. En
augmentant les taux des hormones incrétines dans le sang, la saxagliptine stimule le pancréas pour
qu’il produise plus d’insuline lorsque les taux de glucose dans le sang sont élevés. La saxagliptine
n’agit pas quand la glycémie est basse. La saxagliptine diminue également la quantité de glucose
produite par le foie, en augmentant les taux d’insuline et en diminuant les taux de l’hormone glucagon.
L’effet conjugué de ces processus conduit à la réduction des taux de glucose et contribue à contrôler le
diabète de type 2.
Quelles études ont été menées sur Onglyza?
Onglyza a fait l'objet de dix études principales portant sur plus de 5 000 adultes souffrant de diabète
de type 2.
Quatre études portant sur un total de 2 531 patients ont consisté à examiner Onglyza lorsqu’il était
utilisé en combinaison avec la metformine, une thiazolidinedione, un sulfamide hypoglycémiant ou de
l’insuline avec ou sans metformine, comparant ses effets à ceux d’un placebo (traitement fictif). Une
cinquième étude auprès de 257 patients a permis de comparer Onglyza au placebo lorsqu’il était ajouté
à la metformine et à un sulfamide hypoglycémiant.
Cinq études supplémentaires ont consisté à analyser Onglyza administré en monothérapie, dont quatre
le comparant à un placebo et une le comparant à la metformine chez des patients qui n’avaient pas
reçu de traitement préalable substantiel par médicaments antidiabétiques.
Le principal critère d’évaluation de l’efficacité était la variation du taux sanguin d’une substance
appelée hémoglobine glycosylée (HbA1c), qui donne une indication sur la façon dont le taux de glucose
sanguin est contrôlé. Les taux de HbA1c ont été mesurés après 24 semaines.

Onglyza
EMA/441132/2013
Page 3/4
Quel est le bénéfice démontré par Onglyza au cours des études?
Onglyza a été plus efficace que le placebo pour contrôler le taux sanguin de glucose lorsqu’il était
utilisé comme «adjuvant» chez des patients chez lesquels un traitement antérieur avait échoué.
Chez les patients ayant pris Onglyza en plus de la metformine, les taux de HbA1c ont diminué
d’environ 0,7 % après 24 semaines (d’environ 8,1% à environ 7,4%) alors qu’ils ont augmenté
d’environ 0,1 % chez les patients sous placebo. Pour les patients qui prenaient Onglyza avec un
sulfamide hypoglycémiant ou une thiazolidinedione, les taux de HbA1c ont diminué respectivement de
0,6% et 0,9 %, par rapport à une augmentation d’environ 0,1 % et une diminution d’environ 0,3 %
respectivement chez les patients prenant le placebo. Pour les patients qui prenaient Onglyza avec de
l’insuline (avec ou sans metformine), les taux de HbA1c ont chuté d’environ 0,7%, contre une
diminution d’environ 0,3 % chez les patients prenant le placebo. Pour les patients qui prenaient
Onglyza avec de la metformine et un sulfamide hypoglycémiant, les taux de HbA1c ont chuté
d’environ 0,7%, contre une diminution d’environ 0,1 % chez les patients prenant le placebo à la place
d’Onglyza.
Les études portant sur Onglyza en monothérapie ont révélé qu’en moyenne, chez les patients sous
Onglyza, les taux de HbA1c diminuaient d’environ 0,5 % de plus que chez les patients sous placebo.
Les résultats de l’étude relative à Onglyza plus metformine chez les patients n’ayant pas reçu de
traitement substantiel préalable au moyen de médicaments antidiabétiques n’ont pas été considérés
comme pertinents sur le plan clinique et la société a retiré sa demande concernant l’utilisation
d’Onglyza en tant que médicament d’association initiale chez des patients n’ayant pas suivi de
traitement auparavant.
Quel est le risque associé à l’utilisation d’Onglyza?
Les effets indésirables les plus couramment observés sous Onglyza (chez un à 10 patients sur 100)
sont les suivants: infection des voies respiratoires supérieures (rhumes), infection des voies urinaires
(infection des structures transportant l’urine), gastroentérite (inflammation de l’estomac et de
l’intestin), sinusite (inflammation des sinus), maux de tête, vomissements et œdème périphérique
bénin à modéré (gonflement, surtout des chevilles et des pieds) chez les patients prenant Onglyza en
association avec une thiazolidinedione. Pour une description complète des effets indésirables observés
sous Onglyza, voir la notice.
Onglyza ne doit pas être utilisé chez les personnes pouvant présenter une hypersensibilité (allergie) à
la saxagliptine ou à l’un des autres composants, ou qui ont déjà manifesté une grave réaction
allergique à tout inhibiteur de la DPP-4.
Pourquoi Onglyza a-t-il été approuvé?
Le CHMP a estimé que les bénéfices d’Onglyza sont supérieurs à ses risques et a recommandé l’octroi
d’une autorisation de mise sur le marché pour ce médicament.
Autres informations relatives à Onglyza
La Commission européenne a accordé une autorisation de mise sur le marché valide dans toute l’Union
européenne pour Onglyza, le 1er octobre 2009.
L’EPAR complet relative à Onglyza est disponible sur le site web de l’Agence sous ema.europa.eu/Find
medicine/Human medicines/European Public Assessment Reports. Pour plus d’informations sur le

Onglyza
EMA/441132/2013
Page 4/4
traitement par Onglyza, veuillez consulter la notice (également comprise dans l’EPAR) ou contacter
votre médecin ou votre pharmacien.
Dernière mise à jour du présent résumé: 08-2013.
1
/
4
100%