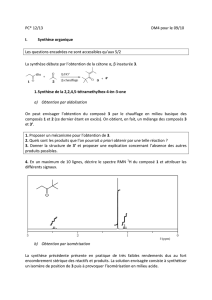
Cristallographie

-1-
Matériaux 7 :
Cristallographie
Conseils et Erreurs trop fréquentes
Les structures métalliques doivent être parfaitement connues, car toutes les autres en dérivent.
Dans les structures métalliques compactes, il est utile de mémoriser les modes d’empilement des couches compactes
pour retrouver la coordinence de 12.
Le contenu d’une maille ionique doit être électriquement neutre.
Ne surtout pas confondre la maille hexagonale compacte et celle du graphite. Les modes d’occupation sont différents.
Les unités peuvent poser des soucis dans le calcul des masses volumiques. Le plus simple est souvent d’utiliser
systématiquement les valeurs dans les unités du système international. Le résultat est alors obtenu en kg.m-3. De façon
générale, les masses volumiques des solides sont de l’ordre de 103 kg.m-3 et 1 g.cm-3.
Quand les cavités ne sont pas symétriques, la condition d’habitabilité doit être recherchée en considérant la plus petite
distance qui relie son centre à la plus proche sphère délimitant la cavité.
Exercices d’entraînement
1. Vrai / Faux et questions courtes
1. Dans un cube, la longueur de la diagonale du cube a, celle d’une face vaut a.
2. Dans une structure cfc, les sphères dures sont tangentes selon l’arête du cube.
3. Il y a 8 sites octaédriques par maille dans une structure cfc.
4. La compacité est différentes pour les structures hc et cfc.
5. La coordinence vaut 8 dans la structure hc et dans la structure cc.
6. Dans une structure type NaCl, les atomes sont tangents selon la diagonale d’une face.
7. Dans une structure du type fluorine, la somme des rayons ioniques du cation et de l’anion vaut a/2.
8. Deux anions sont tangents entre eux dans une structure ionique.
9. Dans une structure de type blende, les cations occupent tous les sites tétraédriques.
10. Déterminer le rapport des deux paramètres d’une maille hexagonale compacte c/a.
11. Dans la glace type diamant, les distances H-O sont toutes identiques.
2. Alliage aluminium-lithium
Le lithium de masse molaire MLi = 6,94 g.mol-1 a, à température ambiante, une structure cubique centrée. Le
paramètre de la maille est a = 350 pm.
1. Calculer la masse volumique du lithium. En déduire une utilisation possible de ce métal.
2. Déterminer la masse d’aluminium (ρAl = 2700 kg.m-3) qu’il conviendrait de remplacer par du lithium dans
un alliage constituant la coque d’un avion pour permettre, à volume constant, le transport d’un voyageur
supplémentaire et de ses bagages, soit 100 kg au total.

-2-
3. Structure hexagonale compacte
Le magnésium (MMg = 24,3 g.mol-1) cristallise dans une structure compacte hexagonale.
1. Représenter la maille conventionnelle de ce métal. Quel est la coordinence des atomes ? Déterminer la
relation entre l’arête a et la hauteur c de la structure hexagonale compacte.
2. Calculer la compacité de la structure.
3. Donner l’expression de la masse volumique en fonction du nombre d’Avogadro NA , de la masse molaire
atomique MMg et de a.
4. La densité du magnésium vaut d = 1,7 (par rapport à l’eau). En déduire une valeur approchée du rayon
atomique de magnésium.
4. Iodure d’argent
L’iodure d’argent présente à température ambiante deux variétés allotropiques : une forme hexagonale et
une forme cubique ayant la structure de la blende que l’on va étudier. Pour la structure de type blende, le
paramètre de la maille noté a, est égal à 649 pm.
1. Sachant que la masse volumique de la structure cubique de AgI vaut ρ = 5710 kg.m-3, déterminer le
nombre d’unités AgI par maille.
2. Représenter la maille conventionnelle en perspective en plaçant les ions iodure au sommet du cube. Quel
est le mode d’empilement de ces ions (sous-réseau I) ?
3. Préciser la position des ions argent : type de site et taux d’occupation. Sachant que, en prenant l’origine
du repère orthonormé sur un ion iodure, l’un d’eux a pour coordonnées (a/4, a/4, a/4), écrire les
coordonnées des autres ions argent dans ce repère.
4. Evaluer la distance séparant deux ions argent plus proches voisins. En déduire la nature du réseau
constitué par les ions argent (sous-réseau II). Préciser le décalage existant entre les deux sous-réseaux.
5. Quelles sont les coordinences anion-cation de ces ions ?
6. Calculer la distance d entre un anion et un cation plus proches voisins. Comparer à la somme de leurs
rayons ioniques et à la somme de leurs rayons covalents.
Données : Masses molaires : MAg = 107,8 g.mol-1 MI = 126,9 g.mol-1
Rayons ioniques : r(Ag+) = 126 pm r(I-) = 216 pm
Rayons covalents : r(Ag) = 134 pm r(I) = 133 pm
5. Graphite
Le carbone à l'état de graphite possède une structure en feuillets.
1. Justifier ce dernier terme, en précisant par un dessin clair, la disposition exacte des feuillets les uns par
rapport aux autres.
2. Quelle est la nature de la maille ? La représenter et positionner les atomes.
3. Calculer les dimensions de la maille, la compacité du réseau, la densité et le volume molaire du graphite.
Données : Distance entre deux feuillets superposés : 0,336 nm
Distance entre deux carbones trigonaux : 0,141 nm
M(C) = 12 g.mol-1 NA = 6,022.1023 mol-1
6. Les alliages or-cuivre : solides de substitution
Le cuivre et l'or cristallisent dans le réseau compact cubique faces centrées. L'or des bijoutiers est un
alliage de substitution composé d'or et de cuivre.
Paramètres de maille : Au : 0,408 nm Cu : 0,361 nm
Masses molaires atomiques : Au : 197,0 g.mol-1 Cu : 63,5 g.mol-1
A) Les cristaux métalliques
A.1. On commence par étudier l'or pur. Calculer :
1. Le rayon métallique de l'atome
2. La compacité du réseau

-3-
3. La distance entre deux plans réticulaires (plans A, B et C formant le réseau cfc par empilement
compact de plans compacts)
4. La masse volumique et sa densité
A.2. Répondre aux mêmes questions concernant le cuivre pur.
B) Les alliages ordonnés or-cuivre
A l'état solide, l'or et le cuivre sont miscibles en toutes proportions. Cependant, pour certaines
compositions de l'alliage, un recuit suivi d'une trempe de la solution solide, peut produire des phases
ordonnées appelées "surstructure". Pour exprimer la teneur en or de l'alliage, l'unité de poids est le carat
(un carat signifie que l’or représente 1/24ème du poids de l’alliage).
B.1. Etude de la phase Cu3Au : La maille est cubique. Les atomes d'or occupent les sommets, les atomes de
cuivre, les centres des faces. L'arête de la maille a pour longueur : a = 0,375 nm.
a) Dessiner la maille.
b) Calculer la masse volumique de l'alliage.
c) Calculer la proportion en or, exprimée en carat.
B.2. Etude de la phase CuAu : La maille est quadratique : il s'agit d'un parallépipède rectangle dont la base
est carrée de côté a = 0,398 nm et dont la hauteur vaut b = 0,372 nm. Les atomes d'or occupent les
sommets de la maille et les milieux des faces supérieures et inférieures ; les atomes de cuivre
viennent au centre des 4 autres faces de la maille. Répondre aux mêmes questions qu'en B.1.
7. Rutile
La structure du rutile TiO2 est constituée d’un arrangement hexagonal
(paramètres a = 296 pm et c = 407 pm) d’ions O2- (R = 136 pm, sphères grises à la
côte 0 et c, sphères blanches à la côte c/2), les ions Ti4+ (r = 60,5 pm, sphères
rouges à la côte c/4 (petites) et 3c/4 (grosse)) occupant un site octaédrique sur
deux. On a représenté cette structure en projection dans le plan contenant la
base de la maille hexagonale.
1. Dessiner la maille en perspective.
2. Calculer la coordinence des ions dans cette structure.
3. L’occupation des sites octaédriques est-elle conforme aux valeurs des rayons ioniques ?
Masses molaires : O : 16,0 g.mol-1 Ti : 47,9 g.mol-1
8. Structure du titanate de baryum
Le titanate de baryum est un solide ionique très utilisé dans l'industrie électronique, en raison de sa forte
constante diélectrique, qui en fait le matériau de base de la fabrication des condensateurs. Sa structure
cristalline, pour des températures supérieures à 120°C est la structure perovskite, dont une maille cubique
élémentaire peut être décrite de la façon suivante :
1. Les ions baryum Ba2+ occupent les sommets du cube
2. Un ion titane Ti4+ occupe le centre du cube
3. Les ions oxydes O2- occupent les centres des faces du cube.
1. Les numéros atomiques du titane et du baryum sont respectivement 22 et 56.
a) Donner la configuration électronique de l'atome de titane
b) Indiquer la période et la colonne de la classification périodique où se trouve le baryum.
2. Représenter la maille et préciser le nombre d'ions de chaque sorte dans chaque maille.
3. Donner la formule du titanate de baryum et vérifier la neutralité de la structure.
4. Dans la structure décrite :
a) Indiquer, pour les ions titane, le nombre d’ions oxydes qui sont ses plus proches voisins.
b) Même question pour les ions baryum.
5. Indiquer la coordinence de chaque cation.

-4-
6. Dans une structure perovskite idéale, tous les cations sont en contact avec les anions qui les entourent.
a) Quelles relations devraient vérifier les rayons des différents ions si la structure du titanate de baryum
était idéale ?
b) Les valeurs des rayons ioniques sont fournies dans les données numériques. La structure du titanate
de baryum est-elle une perovskite parfaite ?
c) Quels sont, en réalité, les cations tangents aux anions ?
7. Calculer le paramètre a de la maille, la compacité et la masse volumique de la perovskite étudiée.
Données : Rayons ioniques : Ti4+ : 68 pm Ba2+ : 135 pm O2- : 140 pm
Masses molaires atomiques : Ba : 137,3 g.mol-1 Ti : 47,9 g.mol-1
9. Germanium et silicium
Les matériaux utilisés pour la conversion thermoélectrique sont des composés intermétalliques comme les
tellures de plomb (PbTe) ou de bismuth (Bi2Te3) et plus récemment l’alliage Si1-xGex. L’épitaxie désigne le
procédé selon lequel une couche monocristalline de l’alliage Si1-xGex est déposée puis croît sur un substrat de
silicium avec des relations structurales précises. La composition de la couche étant différente de celle du
substrat, les paramètres de mailles doivent s’accorder.
Le germanium Ge et le silicium Si purs possèdent tous les deux une structure cristalline de type cubique
analogue à celle du carbone diamant : leurs atomes occupent simultanément toutes les positions d’un réseau
cubique à faces centrées et la moitié de ses sites tétraédriques. Les centres de deux atomes au contact sont
distants de dGe = 241 pm (respectivement dSi = 235 pm)
1. Structure cristalline du germanium
a) Donner la configuration électronique des atomes de carbone, de silicium et de germanium dans leur état
fondamental. Quelle est la configuration électronique externe ? A quelle colonne de la classification
périodique ces éléments appartiennent-ils ?
b) Présenter la maille élémentaire du germanium en perspective et matérialiser la liaison Ge—Ge. Le cristal
est-il ionique ou covalent ? Justifier.
c) Exprimer le paramètre aGe de la maille en fonction de dGe et calculer sa valeur. Déterminer le nombre
d’atomes de germanium par maille élémentaire ; en déduire le nombre d’atomes NGe par unité de volume
et la masse volumique Ge du germanium.
d) Calculer la compacité de la maille cubique.
Le germanium et le silicium, de structures identiques, constituent un alliage non ordonné où les atomes
prennent des positions aléatoires dans une structure de type diamant, de formule Si1-xGex où x représente la
concentration atomique de l’alliage en germanium, telle que 0 < x < 1.
2. Structure cristalline de l’alliage Si1-xGex
a) Expliquer pourquoi Si1-xGex possède la même structure que le silicium et le germanium.
La loi de Vegard, applicable pour une association d’atomes qui cristallisent dans le même système, indique que
le paramètre de la maille a(x) de l’alliage est égal à la combinaison linéaire des paramètres de maille des
différents constituants pondérés par leurs concentrations respectives.
b) Exprimer a(x) en fonction de x et des paramètres aGe et aSi. Calculer sa valeur pour x = 0,25. L’alliage
Si0,75Ge0,25 peut-il facilement croître sur une couche de silicium ?
c) Calculer le nombre d’atomes de germanium N’Ge et le nombre d’atomes de silicium N’Si dans un mètre cube
de Si0,75Ge0,25. En déduire la masse volumique SiGe de cet alliage.
3. Structure de la cristobalite
Le silicium n’existe jamais à l’état natif mais il est présent dans l’écorce terrestre notamment sous forme de
silice SiO2. La cristobalite est l’une des variétés allotropiques de la silice. Les atomes (ou ions) de silicium
occupent les mêmes positions que le cristal de silicium, les atomes (ou ions) d’oxygène étant supposés à mi-
distance de deux atomes (ou ions) de silicium voisins.
a) Indiquer la coordinence du silicium et de l’oxygène dans la cristobalite.

-5-
b) Sachant que la densité de la cristobalite vaut d = 2,32 calculer le paramètre a’ de la maille conventionnelle
cubique.
c) En déduire la plus courte distance Si—O.
Données : NA = 6,02.1023 mol-1
Numéro atomique : C = 6 Si = 14 Ge = 32
M (g.mol-1) : Si = 28,1 Ge = 72,2
Rayon ionique (pm) Si = 40 Ge = 53
Rayon covalent (pm) Si = 118 Ge = 122
10. Structures du fer, de l’acier et d’un oxyde de fer
Le fer peut cristalliser sous deux formes, selon la température. A basse température, la maille conventionnelle
du fer possède la structure cubique centrée ; à haute température, le fer adopte la structure cubique à
faces centrées. La transition s’opère à 910°C sous P° = 1 bar. Puis, au-delà de 1390°C, le fer reprend une
structure cubique centrée.
Ces structures présentent des sites interstitiels qui peuvent être occupés par des atomes, notamment de
carbone (de rayon atomique RC = 77 pm), pour donner lieu à la formation de solutions solides FeCx constituant
les aciers.
Données : R(Fe2+) = 82 pm R(Fe3+) = 67 pm R(O2−) = 132 pm
M(Fe) = 55,9 g.mol−1 M(C) = 12,0 g.mol−1 Na = 6,02.1023 mol−1
A. Etude du Fer
Le fer , variété allotropique stable aux pressions usuelles, cristallise dans une structure de type cubique
centré. Ce réseau présente des sites interstitiels octaédriques et tétraédriques. Les sites octaédriques sont
centrés par exemple au point (½,0,0) ou au point (½,½,1), alors que les sites tétraédriques sont centrés par
exemple au point (½,0,¾).
1. Représenter clairement la maille conventionnelle du fer . Préciser la coordinence ainsi que le nombre
de motifs appartenant en propre à cette maille.
2. Calculer la compacité Cα de ce type d’empilement.
3. Calculer le paramètre a de la maille, sachant qu’à 20°C, la masse volumique vaut = 7868 kg.m−3.
4. Calculer le rayon R de l’atome de fer à 20°C.
5. Représenter un site octaédrique et un site tétraédrique (utiliser un code de couleur ou des symboles de
manière à ce que le correcteur les différencie nettement).
6. Calculer les tailles maximales des atomes pouvant occuper l’un de ses sites octaédriques ou
tétraédriques sans engendrer de déformation de la structure, en tenant compte pour ce calcul de la plus
courte distance entre l’un des sommets de la cavité et le site interstitiel.
7. Que pouvez-vous conclure sur l’insertion du carbone dans le fer α solide ?
B. Etude du Fer γ
Le fer γ cristallise dans une structure compacte de type cubique à faces centrées.
8. Calculer la compacité Cγ d’une structure cubique à faces centrées (modèle des sphères dures
indéformables).
9. Le rayon atomique du fer est R = 129 pm. Calculer le paramètre de maille a de la maille.
10. Evaluer le volume massique v()910 du fer à 910 °C.
11. Où sont situés les sites interstitiels dans le fer ?
12. Quel serait le rayon maximal RO d’un atome qui s’insérerait dans un site octaédrique sans déformer la
structure cristalline ? Calculer RO.
13. Calculer RTγ, taille du site tétraédrique du fer γ.
14. Que pouvez-vous conclure sur la solubilité par insertion du carbone dans le fer γ solide ?
C. Etude de l’oxyde de fer FeO
Le monoxyde de fer FeO est un solide ionique qui cristallise dans une structure de type NaCl.
 6
6
1
/
6
100%