corrigé des activités doc et expérimentales

!
1!
!ASDS&PE!!
TS&SPE!
THÈME!!LES!MATÉRIAUX!
CORROSION!ET!PROTECTION!DES!MÉTAUX!!
!
NOM!:! !......................................!! PRÉNOM!:!.................................!! CLASSE!:!..........................!! DATE!:!!....................................................!!
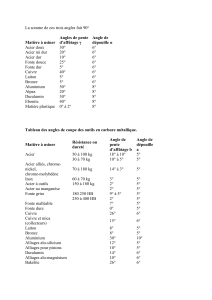
!"#$%&'"'(''")*)'('+,-./0-12/3'4/00/52/3'61'70/16412/3'865'-42605'
!"#$%$#&'($#)*&+'%$$,*&%$#-'.-')+&+$#/+0,*)1"%$2#3%#4%'#-"'2#."#$."$#4.'/%#56,33),7%$2#%$%#/+&,3#3%#-3"$#
"&)3)$+#5,*$#36)*5"$&')%#%%#89&)/%*&:#;3,8.'+#<#-,'&)'#5%#/)*%',)$#-')*0)-,3%/%*�.*$&)&"+$#56.=>5%$2#)3#
$6.=>5%#*,&"'%33%/%*&#<#36,)'#$6)3#*6%$&#-,$#-'.&+7+:#
?,#0.''.$).*#%$&#"*#43+,"#@#.*#%$&)/%#1"%#AB#C#5%#3,#-'.5"0&).*#/.*5),3%#56,0)%'#$.*&#-%'5"$#0D,1"%#,**+%#$."$#4.'/%#5%#
'.")33%:#
E"#/)*%',)#<#3,#'.")33%2#1"%33%$#$.*%$#-')*0)-,3%$#+&,-%$#5%#3,#F)%#5"#4%'#G#
?6D.//%#-%"&H)3#3%$#/.5)4)%'#G#I)#.")2#5,*$#1"%3#8"&#G#
*/49:631'3;<'('=,-./0-12/3'89'>60?'86',-'>/316'61'86',@-4260A'
!
En!Europe,!la!fabrication!du!fer!date!de!1700!ans!av.!J.C.!:!on!
superposait!plusieurs!couches!successives!de!minerai!de!!fer!et!
de!bois!et!on!chauffait!ces!échafaudages.!Le!métal!!fondu!était!
travaillé!sur!place.!Actuellement,!coexistent!deux!!filières!
d’élaboration!de!l’acier:!la!filière!fonte!et!la!
filière!!ferraille.!!Dans!la!filière!fonte,!après!broyage,!le!minerai!
est!introduit!!dans!le!haut!fourneau!avec!du!coke!(constitué!
essentiellement!!de!carbone).!Le!coke!brûle:!la!chaleur!dégagée!
fait!fondre!le!!minerai.!Le!monoxyde!de!carbone,!CO(g),!formé!
par!la!!combustion,!réduit!en!fer!les!oxydes!de!fer!constituant!
le!!minerai.!On!obtient!alors!de!la!fonte!en!fusion.!!
La!fonte!est!!ensuite!acheminée!vers!un!convertisseur!où!du!
dioxygène!est!introduit.!L’oxygène!brûle!une!partie!du!carbone!
et!des!résidus!de!la!fonte;!on!obtient!alors!de!l’acier.!!Dans!la!
filière!ferraille,!la!ferraille,!triée!et!broyée!ou!à!l’état!brut,!est!
introduite!dans!un!four!électrique!:!de!l’acier!en!fusion!est!
obtenu.!
!
!
Du!dioxygène!est!éventuellement!introduit.!!La!production!
d’une!tonne!d’acier!par!la!filière!fonte!s’accompagne!du!
dégagement!de!deux!tonnes!de!dioxyde!de!carbone.!
EJ,-'($#KKK:,0)%':.'7L3,0)%'L0.//%*&H4,8')1"%H&H.*H
3,0)%':D&/3#
!
*/49:631'3;B'('
'C60?'>/316'-4260?'36'7-5'4/3>/3806''
'
'
*/49:631'3;D'(''
C/3412/336:631'8@93'E-91F>/9036-9'
Ces!trois!produits!diffèrent!par!leur!teneur!en!carbone.!!
Le!>60'est!un!matériau!mou!et!malléable,!dont!la!teneur!en!
carbone!est!infime.!!
L’-4260'est!un!alliage!de!fer!et!de!carbone!avec!une!teneur!en!
carbone!pouvant!varier!de!0,03!%!à!2!%!maximum!en!masse;!il!
est!à!la!fois!malléable!et!résistant.!L’acier!inox!est!un!alliage!
d’acier,!de!chrome!(de!16!à!19!%)!et!de!nickel!(9!à!13!%),!et!d’un!
peu!de!carbone!(<!1%).!!
La!>/316,!avec!une!teneur!élevée!de!carbone!(de!2!%!jusqu’à!6!
%),!existe!en!plusieurs!qualités!:!de!malléable!et!ductile(*)!à!très!
dure!et!résistante.!!
D'après!le!site!www.Rohr.frlferraill.htm!
!
MNO#5"0&)3%#@#1")#-%"&#P&'%#+&)'+2#+&%*5"#$,*$#$%#'./-'%:#
#
#
#
#
#
#
#
#
#
#
#
#
#
!
Le!principal!oxyde!de!fer!dans!un!minerai!de!fer!est!
l’hématite!ou!oxyde!de!fer!(III)!Fe2O3(s).!
Sa!réduction!par!le!monoxyde!de!carbone!CO(g),!permet!
d’obtenir,!en!cinq!étapes,!le!fer!ou!ses!alliages,!l’acier!et!la!
fonte.!!
Dans!une!première!étape,!le!carbone!C(s)!du!charbon!de!
coke!réagit!avec!le!dioxygène!O2(g)!pour!donner!du!
dioxyde!de!carbone!CO2(g),!qui!dans!une!seconde!
réaction,!donne!du!monoxyde!de!carbone,!CO(g),!en!
réagissant!avec!le!carbone!solide!C(s).!!
À!la!température!du!haut&fourneau,!l’excès!de!carbone!
permet!la!conversion!de!la!totalité!du!CO2(g)!en!CO(g).!!
Le!CO(g)!produit!réduit!les!oxydes!de!fer!en!trois!étapes:!!
!
&!Pour!320°C!<!!q!<!620°C,!Fe2O3(s)!est!réduit!en!
Fe3O4(s)!!
&!Pour!620°C!<!!q!<!950°C,!Fe3O4(s)!est!réduit!en!FeO(s)!;!!
&!Pour!!q!>!950°C,!FeO(s)!est!réduit!en!Fe(s).!!
!
Au!cours!de!ces!réactions,!CO!(g)!est!oxydé!en!CO2(g).!

!
2!
!
!
*/49:631'3;G'(''
H/00/52/3'86',@-4260I'
Le!phénomène!de!corrosion!correspond!à!la!dégradation!
d’un!métal,!!ou!d’un!alliage!métallique,!par!des!réactifs!
gazeux!ou!en!solution.!!À!l’échelle!de!la!planète,!chaque!
seconde,!cinq!tonnes!d’acier!sont!!oxydées!en!rouille,!
mélange!complexe!d’oxydes!et!d’hydroxydes!!de!fer!plus!ou!
moins!hydratés.!!La!corrosion!est!un!fléau!industriel.!On!
estime!en!effet!que!20!%!de!!la!production!mondiale!d'acier!
sont!perdus!chaque!année!sous!forme!!de!rouille.!La!
corrosion!de!l’acier!est!favorisée!lorsque!l’atmosphère!!est!
humide!et!contient!des!espèces!ioniques!dissoutes.!La!
corrosion!!est!dite!"*)4.'/%#lorsque!toute!la!surface!du!
métal!en!contact!avec!!cette!solution!est!attaquée!de!la!
même!façon,!5)44+'%*&)%33%#si!ce!n’est!!que!partiellement.!
!
*/49:631'3;J'(''
!0/16412/3'86',@-4260'4/3106',-'4/00/52/3I'
La!corrosion!a!des!conséquences!importantes!au!
niveau!!économique.!La!lutte!contre!la!corrosion!permet!de!
rallonger!!la!durée!de!vie!des!objets!en!acier.!!!
On!peut!:!!
&!incorporer!du!chrome!et!du!nickel!à!l’acier!pour!obtenir!
un!!acier!inoxydable!;!
!&!recouvrir!l’acier!d’une!couche!protectrice!
imperméable!!(peinture,!vernis,!plastique)!;!!
&!recouvrir!l’acier!d’un!autre!métal!:!en!plongeant!la!pièce!
d’acier!dans!un!bain!de!zinc!fondu!(galvanisation)!ou!par!
électrozingage!(électrolyse);!!!
&!relier!un!bloc!de!zinc!à!l’objet!en!acier!à!protéger!:!le!zinc!
est!alors!oxydé!et!le!dioxygène!est!réduit!à!la!surface!du!fer!
ou!de!l’acier,!qui!n’est!alors!pas!corrodé!(anode!sacrificielle!
sur!la!coque!des!navires).!
!
*/49:631'3;K'(''
#64L4,-M6'865'-42605'
Même!protégés,!les!aciers!se!corrodent!lentement.!Les!objets!en!acier!corrodé!
peuvent!ensuite!être!recyclés.!Les!exigences!en!matière!de!taux!de!recyclage!des!
véhicules!automobiles!sont!élevées!:!actuellement!54!%!de!l’acier!présent!dans!une!
voiture!est!de!l’acier!recyclé.!Avec!un!taux!de!recyclage!qui!dépasse!les!62!%,!l’acier!
est!le!matériau!le!plus!recyclé!en!Europe.!!
?%#'%0>03,7%#5%#3J,0)%'#-%'/%%#-'+$%'F%'#3%$#'%$$."'0%$#*,&"'%33%$2#5%#'+5")'%#
3J"&)3)$,&).*#5J+*%'7)%#%%#5)/)*"%'#3J+/)$$).*#5%#7,Q#<#%44%%#$%''%:!
'
'
"3-,L56'61'5L31EN56'('
1.!Pourquoi!dans!les!de!mines!de!«!fer!»,!le!fer!n'est!pas!à!l'état!de!«!métal!fer!»!?!
L’oxygène!présent!sur!terre!réagit!avec!le!fer!métallique!pour!former!des!oxydes!de!fer.!Le!minerai!de!fer!est!sous!la!
forme!d’oxydes!de!fer!
'
2.!Justifier!l'utilisation!du!bois!par!les!premiers!métallurgistes.!
Dans!un!haut&fourneau,!les!oxydes!de!fer!sont!réduits!en!métal!fer!;!le!bois!constituait!le!réducteur!des!premiers!
métallurgistes.!Le!bois!apportait!l’élément!carbone!qui,!au!cours!de!la!réaction,!était!oxydé!en!dioxyde!de!carbone!
!
'

!
3!
3.!Comment!obtient&on!l'acier!à!partir!de!la!fonte!?!
!
On!obtient!de!la!fonte!en!chauffant!dans!un!haut&fourneau,!vers!1250°C,!un!mélange!de!minerai!de!fer!et!de!charbon!à!
coke!!
La!fonte!liquide!obtenue!réagit!ensuite!avec!du!dioxygène,!dans!un!convertisseur!vers!1600°C,!qui!brûle!une!partie!du!
carbone!et!des!résidus!présents!dans!la!fonte!:!on!obtient!alors!de!l’acier!
'
4.!Quelle!est!la!différence!entre!la!fonte!et!l'acier!?!
!
L’acier!et!la!fonte!sont!deux!alliages!de!fer!et!de!carbone!mais!les!teneurs!en!carbone!sont!différentes!:!!
2!%!!!en!masse!de!carbone!maximum!pour!l’acier!!
entre!2!et!6!%!!de!carbone!en!masse!pour!la!fonte!!
!
'
5.!Justifier!qu'en!mélangeant!de!la!ferraille!à!(mélange!de!fer!et!d'oxydes!de!fer)!on!obtienne!de!l'acier.!
!
La!ferraille!contient!du!fer!et!des!oxydes!de!fer!;!la!fonte!est!plus!riche!que!l’acier!en!élément!carbone,!une!partie!du!
carbone!de!la!fonte!réduit!les!oxydes!de!la!ferraille!et!se!transforme!en!dioxyde!de!carbone.!Le!taux!global!de!carbone!
diminue!dans!le!mélange!qui!devient!ainsi!de!l’acier!(voir!les!taux!de!carbone!de!la!fonte!et!de!l’acier!dans!le!document!
2).!L’ajout!éventuel!de!dioxygène!permet!d’ajuster!la!transformation!d’une!partie!du!carbone!de!la!fonte!en!dioxyde!de!
carbone!et!d’obtenir!de!l’acier.!
'
6.!Quel!peut!être!le!rôle!de!l'ajout!de!dioxygène!dans!les!deux!filières,!fonte!et!acier!?!
l’ajout!d’oxygène!dans!les!deux!filières,!permet!d’ajuster!le!pourcentage!en!masse!de!carbone,!présents.!
On!obtient!alors!des!aciers!aux!propriétés!mécaniques!différentes!
'
7.!Écrire!les!5!réactions!mises!en!jeu!dans!le!document!n°3.!
!
(1)!C(s)!+!O2(g)!!!CO2(g)!
!
(2)!C(s)!+!CO2(g)!!!2!CO(g)!
!
(3)!3!Fe2O3(s)!+!CO(g)!!!2!Fe3O4(s)!+!CO2(g)!
!
(4)!Fe3O4(s)!+!CO(g)!!!3!FeO(s)!+!CO2(g)!
!
(5)!FeO(s)!+!CO(g)!!!Fe(s)!+!CO2(g)!
!
'
8.!Globalement!dans!le!haut&fourneau,!on!peut!considérer!que!les!réactifs!sont!R#et!S%ATU#,!les!produits!
RTA#et!S%#.!Écrire!la!réaction!globale!de!la!réduction!de!l'oxyde!S%ATU#en!métal!fer.!
!
Globalement!les!deux!réactifs!sont!Fe2O3(s)!et!C(s)!et!les!deux!produits!sont!Fe(s)!et!CO2(g).!!
L’équation!bilan!de!l’ensemble!des!réactions!mises!en!jeu!dans!le!haut&fourneau!est:!!
2!Fe2O3(s)!+!3!C(s)!!4!Fe(s)!+!3!CO2(g)!
'
9.!Qu'est&ce!que!la!rouille?!Pourquoi!un!milieu!marin!favorise&t&il!particulièrement!la!corrosion!de!l'acier!?!
!
La!rouille!est!un!mélange!complexe!d’oxydes!de!fer!et!d’hydroxydes!de!fer!
'
10.!Commenter!les!logos!du!document!5.!
!
Le!fer,!l’acier!et!la!fonte!sont!attirés!par!un!aimant.!Le!logo!du!haut!indique!que!l’acier!est!recyclable!et!qu’il!sera!
vraisemblablement!extrait!d’un!mélange!de!métaux!par!un!électroaimant.!!le!logo!du!bas,!appelé!Point!vert,!indique!que!
le!fabricant!de!ce!matériau!adhère!à!un!système!contribuant!au!recyclage!des!déchets!issus!des!emballages!
'

!
4!
! !
11.!Rédiger!un!commentaire!argumenté!de!la!phrase!en!italique!dans!le!document!6.!
!
?%#'%0>03,7%#5%#3J,0)%'#-%'/%%#-'+$%'F%'#3%$#'%$$."'0%$#*,&"'%33%$2#5%#'+5")'%#3J"&)3)$,&).*#5J+*%'7)%#%%#5)/)*"%'#
3J+/)$$).*#5%#7,Q#<#%44%%#$%''%#
#
Le!recyclage!de!l’acier!permet!de!(doc.6):!!
- préserver!les!ressources!naturelles!:!en!réutilisant!du!fer!usagé,!on!évite!l’extraction!de!nouveau!minerai!de!fer.!
- réduire!l’utilisation!d’énergie!:!la!filière!ferrailles!ne!nécessite!pas!de!dépenser!d’énergie!pour!extraire!le!
minerai!et!le!coke,!elle!ne!nécessite!pas!non!plus!de!haut!fourneau.!
- diminuer!l’émission!de!gaz!à!effet!de!serre!:!lorsqu’on!ajoute!du!dioxygène!pour!éliminer!le!carbone!de!la!fonte,!
il!se!dégage!du!dioxyde!de!carbone!(gaz!à!effet!de!serre).!!
- Cela!n’est!pas!nécessaire!pour!la!filière!ferrailles!
'

!
5!
ASDS&PE!!
TS&SPE!
THÈME!!LES!MATÉRIAUX!
CORROSION!ET!PROTECTION!DES!MÉTAUX!!
!
NOM!:! !......................................!! PRÉNOM!:!.................................!! CLASSE!:!..........................!! DATE!:!!....................................................!!
!"#$%&'O'(''!&'('La!vie!des!aciers!dans!les!milieux!marins'
La!corrosion!de!l’acier!est!favorisée!lorsque!l’atmosphère!est!humide!et!contient!des!espèces!ioniques!dissoutes.!Pour!mettre!
en!évidence!le!phénomène!de!corrosion!en!milieu!maritime,!vous!allez!réaliser!quelques!expériences!simples.'
1.!Identifications!d’ions'
Réaliser!trois!expériences!permettant!d’identifier!les!ions!proposés!dans!des!tubes!à!essais.!
Verser!environ!2!mL!de!la!solution!de!l’ion!à!tester!et!quelques!gouttes!du!réactif!test.!!
Compléter!le!tableau.!
'
!
Ion!à!tester!
Réactif!test!
Observations!
Tube!1!
!
ion!fer!(II)!Fe2+(aq)!
!
ion!hexacyanoferrate!(III)!
[Fe(CN)6]!3&!
Précipité!bleu!
Tube!2!
!
ion!zinc!(ll)!Zn2+(aq)!
!
ion!hexacyanoferrate!(III)!
[Fe(CN)6]!3&!
Précipité!blanc!
Il!apparaît!jaunâtre!!à!cause!de!la!solution!qui!
est!déjà!colorée!
Tube!3!
!
ion!hydroxyde!HO&!(aq)!
!
Phénolphtaléïne!
!
Coloration!rose!!
2.!Corrosion!de!l'acier!en!milieu!marin'
Pour!modéliser!la!corrosion!de!l'acier!en!milieu!marin,!on!dépose!
une!goutte!d'eau!salée!sur!une!plaque!de!fer.!
!
On!observe!
&!Une!coloration!bleue!au!centre!de!la!solution!corrosive!salée!!
&!Une!coloration!rose!sur!les!bords!de!la!solution!!
'
'
!
a. Interpréter!les!deux!observations!précédentes!
!
La!coloration!bleue!au!centre!de!la!solution!corrosive!salée!montre!la!formation!d’ion!
Fe2+(aq)!
Le!fer!est!oxydé!en!ion!fer!II!
Fe(s)!!!Fe2+(aq)!+!2!e–!
La!coloration!rose!sur!les!bords!de!la!solution!montre!la!formation!d’ion!OH&(aq)!
Le!dioxygène!est!réduit!en!ion!hydroxyde!
O2(g)!+2H+!(aq)+!4e–!!!2HO–!(aq)+!!
Ou!par!addition!membre!à!membre!de!2OH&!!!en!tenant!compte!que!H+(aq)+HO–!(aq)!!H2O!
(l)!
O2(g)!+2H+!(aq)+!4e–+2HO–!(aq)!!!2HO–!(aq)+!2HO–(aq)!
et!après!simplification!
O2(g)!+!4e–+2!H2O(l)!!!4HO–!(aq)!!
!
Il!se!produit!une!réaction!d’oxydo&réduction!entre!le!réducteur!Fe!de!la!plaque!d’acier!et!l’oxydant!O2(g)!
Un!transfert!d’électron!à!lieu!entre!le!dioxygène!de!l’air!et!le!fer!
!
Équation!de!la!réaction!de!corrosion!de!l’acier:!
!
!Fe(s)!!!!! Fe2+(aq)!+!2!e&!!(x2)!
+!
! O2(g)!+!2!H2O(l)!+!4!e&!!!! 4!HO&(aq)! ! !(x1)!
!2!Fe(s)!+!O2(g)!+!2!H2O(l)!!!2!Fe2+(aq)!+!4!HO&(aq)!
!
!
!
!
!
!
!
!
'
 6
6
 7
7
 8
8
1
/
8
100%