Biologie moléculaire

Référentiel régional
Biologie moléculaire
Version 4 – 2016 / 2017

Table des matières
Chapitre 1 - Introduction ________________________________________________________ 6
1.1. Présentation du référentiel _______________________________________________________ 7
1.2. Groupe de travail biologie moléculaire – Actualisation 2016 _____________________________ 8
Chapitre 2 - Généralités sur les méthodes d’analyse des anomalies génomiques ___________ 9
2.1. Les anomalies de structures chromosomiques : les translocations _______________________ 10
2.1.1. Méthodes par extraction des acides nucléiques ___________________________________________ 10
2.1.2. Méthodes in situ ____________________________________________________________________ 10
2.2. Amplification et délétion génique _________________________________________________ 11
2.2.1. Méthodes par extraction des acides nucléiques ___________________________________________ 11
2.2.2. Méthodes in situ ____________________________________________________________________ 11
2.3. Les anomalies des gènes : les mutations ____________________________________________ 12
2.3.1. Méthodes par extraction des acides nucléiques ___________________________________________ 12
2.3.2. Méthodes in situ ____________________________________________________________________ 12
2.4. Les nouvelles méthodes d’analyse – Nouveautés 2016 ________________________________ 12
2.4.1. L’analyse par séquençage haut débit ____________________________________________________ 12
2.4.2. L’analyse par ADN tumoral circulant ou biopsie liquide _____________________________________ 13
Chapitre 3 - Prescription en pratique - Actualisation 2016 ___________________________ 14
Chapitre 4 - Essais de therapie ciblée en lien avec la plateforme de génétique des tumeurs _ 17
4.1. Programme de détection prospective des biomarqueurs émergents _____________________ 18
4.2. Programme AcSé - Actualisation 2016 _____________________________________________ 18
Chapitre 5 - Gynécologie – Actualisation 2016 _____________________________________ 20
5.1. Infections HPV _________________________________________________________________ 21
5.2. Cancer de l’endomètre et syndrome de lynch ________________________________________ 22
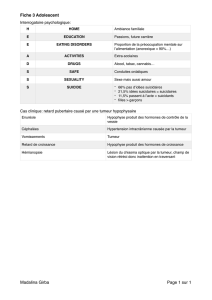
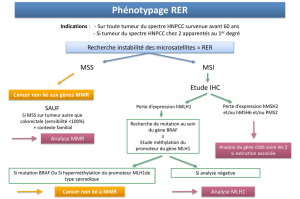
5.2.1. Cancer de l’endomètre et syndrome de Lynch : test MSI /méthylation promoteur MLH _______ 22
5.2.2. Tableau de synthèse du test ___________________________________________________________ 24
5.3. Sarcome du stroma endométrial de bas grade _______________________________________ 25
5.4. Carcinome de l’ovaire, de la trompe, du péritoine, de haut grade _______________________ 26
5.5. Tumeur de la granulosa et mutation FOXL2 _________________________________________ 27
Chapitre 6 - Hématologie ______________________________________________________ 28
6.1. Syndromes myéloproliferatifs ____________________________________________________ 34
6.1.1. Leucémie myéloïde chronique (LMC) ____________________________________________________ 34
6.1.2. La polyglobulie primitive (PV) ou maladie de Vaquez (MV) __________________________________ 36
6.1.3. La Thrombocytémie Essentielle (TE) ____________________________________________________ 37
6.1.4. La myélofibrose primitive (MF) ou splénomégalie myéloïde chronique _________________________ 38
6.2. leucémies aigues _______________________________________________________________ 38
6.2.1. Leucémies aiguës myéloïdes (LAM) _____________________________________________________ 38

6.2.2. Leucémies aiguës lymphoblastiques (LAL) ________________________________________________ 40
6.3. Syndromes lymphoprolifératifs ___________________________________________________ 41
6.3.1. La leucémie lymphoïde chronique (LLC) _________________________________________________ 41
6.3.2. Les lymphomes _____________________________________________________________________ 41
6.3.3. Le myélome multiple (MM) – Actualisation 2016 __________________________________________ 45
Chapitre 7 - Mélanome ________________________________________________________ 46
7.1. mélanome métastatique ________________________________________________________ 47
7.1.1. Thérapie ciblée des mélanomes métastatiques : génotypages BRAF/NRAS/KIT __________________ 47
7.1.2. Tableaux de synthèse des tests ________________________________________________________ 49
Chapitre 8 - Neurologie ________________________________________________________ 52
8.1. génotypage utile à visée thérapeutique, diagnostique et pronostique ____________________ 53
8.1.1. La recherche de la co-délétion 1p19q à visée thérapeutique _________________________________ 53
8.1.2. La recherche de la co-délétion 1p19q à visée diagnostique et pronostique _____________________ 53
8.1.3. Génotypage utile à visée pronostique : méthylation du géne MGMT __________________________ 55
8.1.4. Autres examens utiles _______________________________________________________________ 56
Chapitre 9 - orl _______________________________________________________________ 57
Chapitre 10 - Pathologie digestive ________________________________________________ 58
10.1. Cancer colorectal ____________________________________________________________ 59
10.1.1. Diagnostic du syndrome de Lynch : test MSI /génotypage BRAF/méthylation promoteur MLH1 ____ 59
10.1.2. Traitement adjuvant des cancers colorectaux de stade II : test MSI ___________________________ 61
10.1.3. Thérapie ciblée des cancers colorectaux métastatiques : génotypage RAS/BRAF _________________ 62
10.1.4. Programme INCa de détection prospective des biomarqueurs émergents ___________________ 63
10.1.5. Programme AcSé ____________________________________________________________________ 63
10.1.6. Polypose __________________________________________________________________________ 64
10.1.7. Tableaux de synthèse des tests ________________________________________________________ 65
10.2. Gist _______________________________________________________________________ 70
10.2.1 Génotypage KIT /PDGFRA à visée diagnostique ___________________________________________ 70
10.2.2 Génotypage KIT/ PDGFRA et traitement par imatinib _______________________________________ 70
10.2.3 Tableaux de synthèse des tests ________________________________________________________ 71
10.3. Cancers gastriques ___________________________________________________________ 72
10.3.1. A visée thérapeutique ________________________________________________________________ 72
10.3.2. Programme AcSé ____________________________________________________________________ 73
10.3.3. Tableau des tests ___________________________________________________________________ 74
10.4. Cancer œsophage, canal anal ___________________________________________________ 75
10.5. Cancer du foie _______________________________________________________________ 75
10.3.4. Cholangiocarcinome et le programme AcSé ______________________________________________ 75
10.3.5. Cancer du foie et le programme AcSé ___________________________________________________ 75
10.6. Tumeur bénigne du foie _______________________________________________________ 75
10.3.6. Génotypages utiles à la classification des adénomes hépatocellulaires_________________________ 76
10.7. Cancer du pancréas ___________________________________________________________ 76
10.8. Tumeurs endocrines __________________________________________________________ 76

10.9. Lymphomes digestifs _________________________________________________________ 76
10.10. Sarcomes (Autres que Gist) ____________________________________________________ 76
Chapitre 11 - Pneumologie ______________________________________________________ 77
11.1. A visée thérapeutique ________________________________________________________ 78
11.1.1. Prescription d’inhibiteurs de tyrosine kinase d’EGFR _______________________________________ 78
11.2. Prescription d’inhibiteurs de ALK et MET : Crizotinib (Xalkori) ________________________ 80
11.3. A visée diagnostique et pronostique _____________________________________________ 82
11.4. Les programmes en cours ______________________________________________________ 82
11.4.1. Programme de détection prospective des biomarqueurs émergents dans le cancer du poumon ____ 82
11.4.2. Programme AcSé ____________________________________________________________________ 85
Chapitre 12 - Sarcome - Actualisation 2016 ________________________________________ 87
12.1. Tableaux de synthèse des tests réalisés sur la plateforme de génétique des cancers de Midi-
Pyrénées 88
12.1.1. Réarrangement du gène SYT __________________________________________________________ 88
12.1.2. Réarrangement du gène EWSR1 (EWS) __________________________________________________ 89
12.1.3. Réarrangement du gène DDIT3 ________________________________________________________ 91
12.1.4. Réarrangement du gène ALK __________________________________________________________ 92
12.1.5. Réarrangement du gène TFE3 _________________________________________________________ 93
12.1.6. Réarrangement du gène ETV6 _________________________________________________________ 94
12.1.7. Amplification du gène MDM2 _________________________________________________________ 95
12.1.8. Translocation t(17 ;22)(q22 ; q23) ______________________________________________________ 96
12.1.9. Amplification de c-myc _______________________________________________________________ 97
12.1.10. Sarcomes du stroma endométrial ______________________________________________________ 98
12.1.11. Mutation du gène de la béta-caténine (CTNNB1) __________________________________________ 99
12.1.12. Génotypage KIT / PDGFRA ___________________________________________________________ 100
12.2. Tableaux de synthèse des tests réalisés à l’Institut Bergonié _________________________ 101
Chapitre 13 - Sénologie -Actualisation 2016 _______________________________________ 104
12.3. A visée thérapeutique _______________________________________________________ 105
12.1.13. Prescription de thérapie ciblée anti HER2 _______________________________________________ 105
12.4. Génotypage utile au diagnostic ________________________________________________ 107
12.5. Génotypage utile au traitement ________________________________________________ 108
Chapitre 14 - Thyroïde– Actualisation 2016 ________________________________________ 109
14.1. Génotypage utile au diagnostic et au traitement __________________________________ 110
14.2. Programme AcSé ____________________________________________________________ 111
14.2.1. Translocation de ALK _______________________________________________________________ 111
14.2.2. Mutation de ALK ___________________________________________________________________ 111
14.2.3. Mutation de MET __________________________________________________________________ 111
Chapitre 15 - Urologie _________________________________________________________ 112
15.1. Cancers du rein– Actualisation 2016 ____________________________________________ 113

15.2. Cancers de la vessie _________________________________________________________ 114
15.3. Carcinomes urothéliaux des voies excrétrices _____________________________________ 114
15.4. Cancers de prostate _________________________________________________________ 114
Chapitre 16 - Annexes _________________________________________________________ 115
16.1. Tableau récapitulatif des examens de biologie moléculaire __________________________ 116
16.2. Charte graphique des arbres décisionnels ________________________________________ 122
16.3. Tables des illustrations _______________________________________________________ 123
16.3.1. Arbres décisionnels _________________________________________________________________ 123
16.3.2. Tableaux _________________________________________________________________________ 123
16.3.3. Figures ___________________________________________________________________________ 124
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
1
/
119
100%