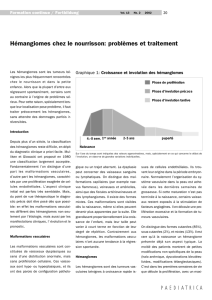
II-4 Les malformations vasculaires

UNIVERSITÉ DE NANTES
FACULTÉ DE PHARMACIE
ANNÉE 2011 N° 2
THÈSE
pour le
DIPLÔME D’ÉTAT
DE DOCTEUR EN PHARMACIE
par
Aurélie Trochu
Présentée et soutenue publiquement le 23 mars 2011
Président :
Mme Céline COUTEAU, Maître de Conférences de Cosmétologie
Membres du jury :
Mme Laurence COIFFARD, Professeur de Cosmétologie
Mme Martine CHAUVELON, Pharmacien
LES « ANGIOMES » ET LEURS TRAITEMENTS,
UNE SOLUTION THÉRAPEUTIQUE D’AVENIR :
LES BÊTABLOQUANTS

Sommaire
Introduction ............................................................................................................................................. 8
Partie I - La peau ................................................................................................................................... 10
I-1 La structure de la peau ................................................................................................................ 11
I-1-1 L’épiderme .......................................................................................................................... 12
I-1-1-1 Les différentes couches de l’épiderme ............................................................ 12
I-1-1-2 Les différents types de cellules et leurs fonctions .......................................... 14
I-1-1-3 La régulation de l’homéostasie épidermique .................................................. 15
I-1-2 Le derme .............................................................................................................................. 15
I-1-2-1 Les couches du derme ..................................................................................... 16
I-1-2-2 Les cellules du derme ...................................................................................... 17
I-1-3 L’hypoderme ....................................................................................................................... 17
I-2 Les annexes cutanées .................................................................................................................. 18
I-2-1 Les poils et les follicules pileux .......................................................................................... 18
I-2-1-1 La structure du poil ......................................................................................... 19
I-2-1-2 La structure du follicule pileux ........................................................................ 19
I-2-2 Les glandes sébacées ........................................................................................................... 21
I-2-3 Les glandes sudoripares ....................................................................................................... 22
I-2-4 Les ongles ............................................................................................................................ 23
I-3 La vascularisation de la peau ....................................................................................................... 24
I-3-1 Le système artériel ............................................................................................................... 25
I-3-2 Le système veineux ............................................................................................................. 26
I-3-3 Les glomus neuro-vasculaires ............................................................................................. 26
I-3-4 Le système lymphatique ...................................................................................................... 26
I-3-5 La formation des vaisseaux sanguins et lymphatiques cutanés ........................................... 26
I-3-5-1 La vasculogenèse ............................................................................................ 27

~ 3 ~
I-3-5-2 L’angiogenèse ................................................................................................. 27
I-3-5-3 La lymphangiogenèse ...................................................................................... 28
I-3-6 La régulation du débit sanguin ............................................................................................ 28
I-4 L’innervation cutanée ................................................................................................................. 29
I-4-1 L’innervation cutanée sensorielle ........................................................................................ 30
I-4-2 L’innervation cutanée végétative ........................................................................................ 31
I-5 Les différentes fonctions de la peau ........................................................................................... 31
I-5-1 La protection de l’organisme ............................................................................................... 31
I-5-2 Le rôle de la peau dans la perception .................................................................................. 33
I-5-3 La thermorégulation ............................................................................................................. 34
I-5-4 Les fonctions métaboliques de la peau ................................................................................ 34
Partie II - Les angiomes ......................................................................................................................... 36
II-1 La classification des angiomes .................................................................................................. 37
II-1-1 Les tumeurs vasculaires ...................................................................................................... 38
II-1-2 Les malformations vasculaires ........................................................................................... 38
II-1-2-1 Les formes isolées à flux lent ........................................................................ 38
II-1-2-2 Les formes isolées à flux rapide .................................................................... 38
II-1-2-3 Les formes complexes ................................................................................... 38
II-2 Les définitions ........................................................................................................................... 39
II-3 Les tumeurs vasculaires .............................................................................................................. 39
II-3-1 Les hémangiomes infantiles ............................................................................................... 39
II-3-1-1 L’épidémiologie ............................................................................................. 39
II-3-1-2 Les aspects cliniques des hémangiomes infantiles ......................................... 40
II-3-1-3 Les diverses localisations des hémangiomes du nourrisson .......................... 41
II-3-1-4 Le diagnostic des hémangiomes infantiles ..................................................... 43
II-3-1-5 L’évolution des hémangiomes infantiles ....................................................... 44

~ 4 ~
II-3-1-6 Les complications des hémangiomes infantiles ............................................. 46
II-3-1-7 La physiopathologie des hémangiomes infantiles ......................................... 48
II-3-2 Les hémangiomes congénitaux .......................................................................................... 49
II-3-3 L’hémangiome en touffe .................................................................................................... 51
II-3-4 L’hémangioendothéliome kaposiforme .............................................................................. 51
II-4 Les malformations vasculaires .................................................................................................. 52
II-4-1 Les malformations capillaires : les angiomes plans ........................................................... 52
II-4-1-1 L’angiome plan : la forme habituelle ............................................................. 52
II-4-1-2 Le syndrome Sturge-Weber-Krabbe .............................................................. 54
II-4-1-3 Le syndrome Klippel-Trenaunay ................................................................... 54
II-4-1-4 Le syndrome de Cobb .................................................................................... 55
II-4-1-5 Les autres malformations capillaires ............................................................. 55
II-4-2 Les malformations veineuses ............................................................................................. 56
II-4-3 Les malformations lymphatiques ....................................................................................... 57
II-4-4 Les malformations artério-veineuses ................................................................................. 58
II-4-5 Les malformations vasculaires complexes ......................................................................... 60
Partie III - Les Traitements ................................................................................................................... 63
III-1 Les traitements des tumeurs vasculaires ................................................................................... 64
III-1-1 Les traitements des hémangiomes infantiles ..................................................................... 64
III-1-1-1 Les traitements classiques pour les formes simples ...................................... 64
III-1-1-2 Les traitements classiques pour les formes graves ........................................ 65
III-1-1-3 Une nouvelle thérapeutique : les β-bloquants ............................................... 73
III-1-2 Les traitements des autres hémangiomes ........................................................................... 80
III-1-2-1 Le traitement des hémangiomes congénitaux R.I.C.H. et N.I.C.H. .............. 80
III-1-2-2 Le traitement de l’hémangiome en touffe .................................................... 81
III-1-2-3 Le traitement de l’hémangioendothéliome kaposiforme .............................. 81

~ 5 ~
III-1-2-4 Le traitement du syndrome de Kasabach-Merritt ......................................... 81
III-2 Les traitements des malformations vasculaires ......................................................................... 82
III-2-1 Les traitements des angiomes plans ................................................................................... 82
III-2-1-1 Le traitement pour la forme habituelle .......................................................... 82
III-2-1-2 Le traitement du syndrome de Sturge-Weber-Krabbe ................................. 84
III-2-1-3 Le traitement du syndrome de Klippel-Trenaunay........................................ 85
III-3 Les traitements des malformations veineuses ...................................................................... 85
III-3-1 La sclérothérapie percutanée ........................................................................... 85
III-3-2 La chirurgie ...................................................................................................... 86
III-3-3 Le laser veineux endovasculaire ...................................................................... 86
III-3-4 Les mesures préventives .................................................................................. 86
III-4 Les traitements des malformations lymphatiques ................................................................ 87
III-4-1 Le traitement de la poussé inflammatoire ........................................................ 87
III-4-2 La chirurgie ...................................................................................................... 87
III-4-3 La sclérothérapie .............................................................................................. 88
III-4-4 Le laser ............................................................................................................ 88
III-5 Les traitements des malformations artério-veineuses .......................................................... 88
Conclusion ............................................................................................................................................. 91
Bibliographie ......................................................................................................................................... 93
Annexes ............................................................................................................................................... 101
Liste des abréviations
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
1
/
117
100%