Choix raisonné des examens complémentaires spécifiques à

Introduction
La maladie de Carré, due au CDV (Canine Distemper
Virus), est toujours d’actualité et se révèle souvent difficile à
diagnostiquer en pratique courante, malgré l’existence de
plusieurs méthodes spécifiques : recherche des inclusions
cellulaires ou corps de Lentz, mise en évidence d’anticorps
spécifiques, mise en évidence des antigènes du virus respon-
sable par immunocytologie et immunohistologie, et RT-PCR
(Reverse Transcription-Polymerase Chain Reaction).
Ceci pose un problème important de par la contagiosité et
le pronostic sombre de cette maladie.
Pour toutes ces raisons, lors de suspicion de maladie de
Carré, une association raisonnée de différents examens
complémentaires s’impose. Hormis les exigences écono-
miques, deux critères doivent orienter leur choix :
— le stade d’évolution de la maladie ; en effet, la sensibi-
lité des différentes méthodes varie en fonction du stade
d’évolution de la maladie ;
— le statut vaccinal de l’animal suspect.
Enfin, si l’ensemble de ces critères peut permettre d’abou-
tir à un diagnostic dans presque tous les cas par une démarche
raisonnée, le vétérinaire reste pourtant démuni, dans la
mesure où les examens complémentaires nécessaires sont
encore pour beaucoup réalisés dans des laboratoires expéri-
mentaux.
FORMATION PERMANENTE
Choix raisonné des examens complémentaires
spécifiques à effectuer lors de suspicion
de maladie de Carré
S. MAURER et ° C. TRUMEL
°Service de Pathologie médicale des équidés et des carnivores, École Nationale Vétérinaire, 23, chemin des Capelles, F-31076 Toulouse Cedex 3
RÉSUMÉ
Lors de suspicion de maladie de Carré chez un chien, le choix des exa-
mens complémentaires à effectuer est primordial afin d’obtenir un diagnos-
tic le plus fiable possible. Pour cela, il est nécessaire de prendre en compte
l’évolution de la maladie ainsi que le statut vaccinal de l’animal. En fonc-
tion de ces éléments, on choisira l’association de différentes méthodes :
recherche ou cinétique d’anticorps (Ac) sur prélèvements sanguins ou de
Liquide Céphalo-Rachidien (LCR), recherche des corps de Lentz sur diffé-
rents frottis. Selon les premiers résultats, d’autres examens s’avéreront ou
non nécessaires pour renforcer ou confirmer le diagnostic : immunocytolo-
gie, Reverse Transcription-Polymerase Chain Reaction (RT-PCR) ou
recherche d’anticorps sur prélèvement de LCR.
MOTS-CLÉS : morbillivirus - diagnostic - maladie de
Carré - chien.
SUMMARY
Reasoned choice for specific complementary tests in case of canine dis-
temper suspicion. By S. MAURER and C. TRUMEL.
In case of Canine Distemper suspicion, a constructive choice for specific
complementary tests is essential to obtain the most reliable diagnosis.
Therefore, it is necessary to take into account the evolution of the disease as
well as the vaccinal status of animal.
According to these elements, we will choose an association of different
methods : antibodies research or kinetics on blood or cerebrospinal fluid
(CSF) samples, research of specific inclusion bodies from different smears.
According to these results, other tests will be necessary to strengthen or
confirm the diagnosis : immunocytology, Reverse Transcription-
Polymerase Chain Reacton (RT-PCR) or antibodies research on CSF
samples.
KEY-WORDS : morbillivirus - diagnosis - canine distem-
per - dog.
Revue Méd. Vét., 2000, 151, 2, 157-161

1. L’animal est présenté en
consultation dans les dix pre-
miers jours suivant l’apparition
des signes cliniques
Les symptômes apparaissent environ une dizaine de jours
après l’infection. Ainsi, dans les dix premiers jours suivant le
début des signes cliniques, soit lors des 21 premiers jours
post-infection, on réalise :
A) SI L’ANIMAL N’EST PAS VACCINÉ
•une prise de sang pour une détection d’anticorps. La
méthode utilisée devrait permettre de doser les immunoglo-
bulines M (Ig M), prépondérantes en début de maladie [8 ,9] ;
•les frottis suivants, pour y rechercher les corps de Lentz
ou inclusions [5] (Figures 1 et 2) :
* frottis sanguin [21, 22],
* frottis conjonctival [16],
* frottis des muqueuses génitales [6],
* frottis d’un culot urinaire [4],
* adénogramme, d’autant plus intéressant que l’animal est
présenté tardivement (car les inclusions y persistent plus
longtemps) [10, 11].
Si ces résultats se révèlent négatifs, il est fort possible que
l’animal ne soit pas atteint de maladie de Carré, mais le dia-
gnostic d’exclusion n’est pas fait. Il faut alors réaliser :
* une immunocytologie sur les frottis conjonctivaux, des
muqueuses génitales et du culot urinaire [4, 7, 13],
ou
* une RT-PCR sur prélèvement sanguin [17].
B) SI L’ANIMAL EST VACCINÉ
•deux prises de sang pour la détection d’anticorps, à trois
semaines d’intervalle, afin de mettre en évidence un accrois-
sement du titre en anticorps spécifiques [3, 8, 9],
•les mêmes frottis que précédemment, afin de rechercher
les corps de Lentz et éventuellement d’effectuer une immu-
nocytologie [15].
La mise en œuvre d’une RT-PCR est préférable à une ciné-
tique de production d’anticorps lorsque l’on veut un diagnos-
tic rapide. Cette méthode est applicable uniquement sur les
chiens ayant été vaccinés depuis plus de trois semaines [17].
2. L’animal est présenté après
plus de deux semaines d’évolu-
tion clinique et/ou avec des
symptômes nerveux
Dans ces cas, on réalise :
A) SI L’ANIMAL N’EST PAS VACCINÉ
•Une seule prise de sang pour la recherche des anticorps
spécifiques du CDV. Il est intéressant d’avoir les titres res-
pectifs d’Ig G et d’Ig M, car ceci permet d’émettre un pro-
nostic sur l’évolution de la maladie [12, 14, 23] :
* si le titre obtenu en Ig G est important, l’animal a des
chances de récupérer,
* si le titre en Ig M obtenu est prépondérant, il est fort pro-
bable que l’animal ait une infection persistante.
Si la sérologie s’avère négative, cela peut signifier :
°que l’animal n’est pas atteint par la maladie de Carré,
°qu’il est atteint d’une affection grave avec forte immuno-
dépression.
Dans ce cas, on pourra noter une immunodépression avec
diminution des Gamma-globulines sur le tracé électrophoré-
tique.
•Si cet examen se révèle négatif, on ne peut cependant pas
affirmer avec certitude que l’animal n’est pas atteint de mala-
die de Carré. Pour renforcer cette certitude, il faut réaliser en
plus :
* une ponction de Liquide Céphalo-Rachidien (LCR) sur
lequel on réalise une recherche des anticorps, le calcul de
l’index I (Figure 3), une recherche des corps de Lentz (Figure
4) et éventuellement une immunocytologie [1, 2, 18, 19],
* une RT-PCR sur ponction ou biopsie ganglionnaire. En
effet, à ce stade de la maladie, la virémie est si faible que,
même si cette technique est très sensible (en théorie, une
seule cellule mononucléée par prélèvement de sang périphé-
rique infectée par le CDV suffit), on a beaucoup plus de
chances de récolter des cellules lymphoïdes infectées au
niveau des nœuds lymphatiques. La technique, même si elle
n’est pas décrite, serait tout aussi sensible sur des cellules
récoltées par ponction de moelle osseuse [11, 17].
B) SI L’ANIMAL EST VACCINÉ
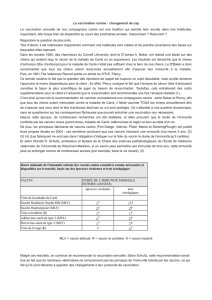
•Ponction de LCR :
* on recherche en parallèle les anticorps anti-CDV et anti-
Parvovirus, de façon à faire la différence entre une synthèse
d’anticorps intrathécale et un passage d’anticorps vaccinaux
à travers la barrière hémato-méningée [19],
* le calcul de l’index I serait intéressant, mais nous verrons
en conclusion que, selon le laboratoire auquel on s’adresse, il
n’est pas toujours calculable,
* on recherche des corps de Lentz après avoir réalisé un
frottis [1].
•Si ces résultats s’avèrent négatifs, le diagnostic d’exclu-
sion est renforcé mais non certifié. Pour aller plus loin, une
immunocytologie sur le frottis de LCF ou une RT-PCR
devraient être réalisées.
Conclusion
Face à cette maladie extrêmement contagieuse et virulente,
le diagnostic de certitude est souvent fait après analyse histo-
logique ou immunohistologique des prélèvements d’autop-
sie.
On a cependant à l’heure actuelle la possibilité, en routine,
de rechercher les corps de Lentz (cytologie), d’effectuer une
Revue Méd. Vét., 2000, 151, 2, 157-161
158 MAURER (S.) ET TRUMEL (C.)

immunocytologie et de faire appel à un laboratoire effectuant
la recherche des Ac spécifiques.
La recherche des corps de Lentz sur frottis cellulaire est
une méthode simple, peu onéreuse (lames, colorants rapides)
et rapide puisqu’elle est réalisée par le praticien. Cette
recherche doit orienter mais non confirmer à elle seule le dia-
gnostic ; en effet, on peut trouver des inclusions sur des pré-
lèvements issus de chiens atteints par différents virus respira-
toires ou traités au chloramphénicol. De plus, cette lecture
nécessite une certaine habitude afin de ne pas confondre les
corps de Lentz avec certaines images (artéfacts de coloration,
hématies phagocytées par un macrophage, lobes de polynu-
cléaires nucléaires ou produits de sécrétion). Enfin, leur per-
sistance, même si elle est variable, est très fugace dès lors que
les symptômes cliniques apparaissent.
En ce qui concerne le dosage des titres en anticorps, il se
fait à partir de sérum, est gratuit si l’on s’adresse auprès du
laboratoire fournisseur de vaccins et les résultats nécessitent
un délai d’à peu près une semaine. Actuellement en France,
seule la méthode en immunofluorescence indirecte (IFI) est
utilisée pour ces dosages, technique décrite comme la moins
sensible et la moins spécifique (par rapport aux méthodes
ELISA et Séroneutralisation). De plus, il serait intéressant,
selon le stade et la forme de la maladie de doser séparément
les titres en Ig G et Ig M, mais cela est actuellement impos-
sible puisque Virbac ne permet pas le dosage des titres en
Ig G et Mérial ne réalise qu’un dosage global en anticorps
(Ig G et M confondues). Dans le premier cas, des risques de
faux négatifs existent lors des trois premières semaines
d’évolution d’une infection non fatale ou lors d’infection per-
sistante. Dans le deuxième cas, les risques de faux négatifs
sont moins importants mais aucun pronostic sur l’évolution
de la maladie ne peut être réalisé. Dans les deux cas, des faux
négatifs existeront lors d’infection aiguë mortelle.
L’immunocytologie, effectuée par certains laboratoires
d’anatomopathologie (par exemple Mérial), est réalisée à
partir de lames fixées à l’acétone à 4°C pendant dix minutes.
Pour obtenir un résultat fiable, il faut effectuer au moins trois
prélèvements différents (frottis conjonctival, génital et uri-
naire), voire quatre (frottis ganglionnaire) lorsque l’on s’ap-
proche du 21ejour post-infection. Passé ce délai, la sensibi-
lité de la méthode diminue fortement pour devenir nulle
après le 60e jour post-infection ; une immunocytologie sur
LCR peut alors s’avérer utile. Cette méthode, nécessitant plu-
sieurs prélèvements, s’avère assez onéreuse.
Revue Méd. Vét., 2000, 151, 2, 157-161
CHOIX RAISONNÉ DES EXAMENS COMPLÉMENTAIRES À EFFECTUER LORS DE SUSPICION DE MALADIE DE CARRÉ 159
FIGURE 1. — Frottis sanguin coloré au MGG, Gx400 : corps de Lentz dans
un lymphocyte.
FIGURE 3. — Calcul de l’index I. FIGURE 4. — Frottis de LCR, coloré au MGG, Gx1000 : corps de Lentz dans
un macrophage.
FIGURE 2. — Frottis conjonctival coloré au MGG, Gx1000 : corps de Lentz
dans une cellule épithéliale.
INDEX I
Il est calculé à partir des concentrations en Ig G et en Albumine
(Alb) du sang et du LCR, obtenues par méthode ELISA et converties
en intensités colorimétriques. Ces intensités sont alors reformulées en
valeurs de Densité Optique (DO) grâce à un terminal informatique.
On obtient ainsi I :
[DOLCRIgG / DOSérumIgG] / [DOLCRAlb / DOSérumAlb]
Les valeurs normales de I sont comprises entre 0,2 et 1,3.
Lorsque I est compris entre 1,3 et 2,8, une maladie inflammatoire du
SNC peut être suspectée.
Si I est supérieur ou égal à 2,8, il y a synthèse intrathécale d’Ac (et
non pas seulement passage hémato-méningé d’Ig).

160 MAURER (S.) ET TRUMEL (C.)
Revue Méd. Vét., 2000, 151, 2, 157-161
PUBLICITÉ

Les deux méthodes les plus sensibles et spécifiques exis-
tant sont l’isolement du virus et la RT-PCR. La première
n’est pas utilisée dans les laboratoires de diagnostic courant
car trop lourde à mettre en œuvre et trop onéreuse. La
seconde, effectuée à partir de prélèvement sanguin hépariné,
de prélèvements urinaire ou ganglionnaire additionnés d’un
conservateur ou de prélèvement de LCR récent, n’est à
l’heure actuelle que peu développée (INV), mais s’annonce
être la technique de prédilection pour le futur.
Dans tous les cas, quelques soient les méthodes diagnos-
tiques choisies par le praticien, les résultats seront toujours
interprétés en fonction des signes cliniques.
Bibliographie
1. — ABATE O., BOLLO E., LOTTI D. et BO S. : Cytological, Immu-
nocytochemical and Biochemical Cerebrospinal Fluid investigations
in Selected Central Nervous System Disorders of Dogs. J. Vet. Med.,
1998, 45, 73-85.
2. — ALLEMAN A.R., CHRISTOPHER M.M., STEINER D.A. et
HOMER B.L. : Identification of Intracytoplasmic Inclusion Bodies in
Mononuclear Cells from the Cerebrospinal Fluid of a Dog with
Canine Distemper. Vet. Pathol., 1992, 9, 84-85.
3. — BLIXENKRONE-MOLLER M., PEDERSEN I.R., APPEL M.J. et
GRIOT C. : Detection of IgM antibodies against canine distemper
virus in dog and mink sera employing enzyme-linked immunosorbent
assay (ELISA). J. Vet. Diagn. Invest., 1991, 3, 3-9.
4. — BROWN R.A.L., MORROW A., HERON H. et CHONG S.N. :
Immunocytochemical confirmation of a diagnosis of canine distem-
per using cells in urine. J. Small Anim. Pract., 1987, 28, 845-851.
5. — DOBOS-KOVACS M. : Studies on the diagnostic value of cell inclu-
sions in Canine Distemper. Acta Vet. Acad. Sci. Hung., 1975, 25,
185-200.
6. — FAIRCHILD G.A., WYMAN M. et DONOVAN E.F. : Fluorescent
Antibody Technique as a Diagnostic test for Canine Distemper
Infection : detection of Viral Antigen in Epithelial Tissues of
Experimental Infected Dogs. Am. J. Vet. Res., 1964, 28, 761-768.
7. — FAIRCHILD G.A., STEINBERG S.A. et COHEN D. : The fluores-
cent antibody test for canine distemper in naturally infected dogs.
Cornell Vet., 1971, 61, 214-223.
8. — GEMMA T., IWATSUKI K., SHIN Y.S., YOSHIDA E., KAI C. et
MIKAMI T. : Serological Analysis of Canine Distemper Virus Using
an Immunocapture ELISA. J. Vet. Med. Sci., 1996, 58, 791-794.
9. — GEMMA T., MIYASHITA T., SHIN Y.S., OKITA M., MORI T.,
IWATSUKI K., MIKAMI T. et KAI C. : Serological survey of Canine
Distemper virus Infection Using Enzyme-Linked Immunosorbent
Assay. J. Vet. Med. Sci., 1995, 57, 761-763.
10. — IWATSUKI K., OKITA M., OCHIKUBO F., GEMMA T., SHIN Y.S.,
MIYASHITA T. et KAI C. : Immunohistochemical Analysis of the
Lymphoïd Organs of Dogs Naturally Infected with Canine Distemper
Virus. J. Comp. Path., 1995, 115, 185-190.
11.—KRAKOWKA S., HIGGINS R.J. et KOESTNER A. : Canine
Distemper Virus : Review of Structural and Functional Modulations
in Lymphoid Tissues. Am. J. Vet. Res., 1980, 41, 284-292.
12. — MIELE J.A. et KRAKOWKA S. : Antibody Responses to Virion
Polypeptides in gnotobiotic Dogs infected with canine Distemper
Virus. Infect. Immun., 1983, 41, 869-871.
13. — MOULTON J.E. et BROWN C.H. : Antigenicity of Canine
Distemper Inclusion Bodies as Demonstrated By Fluorescent
Antibody Technic. P.S.E.B.M., 1954, 86, 99-102.
14. — NOON K.F., ROGUL M., BINN L.N., KEEFE T.J. et MARCH-
WICKI R.H. : Enzyme-Linked Immunosorbent Assay for Evaluation
of Antibody to Canine Distemper Virus. Am. J. Vet. Res., 1980, 41,
605-609.
15. — PALMER D.G., HUXTABLE C.R. et THOMAS J.B. :
Immunohistochemical demonstration of canine distemper virus anti-
gen as an aid in the diagnosis of canine distemper encephalomyelitis.
Res. Vet. Sci., 1990, 49, 177-181.
16. — COWELL R.L., TYLER R.D. et MEINKOTH J.H. : Diagnostic cyto-
logy and hematology of the dog and cat. Second edition. Saint Louis,
MO, 1999.
17. — SHIN Y.S., MORI T. et OKITA M. : Detection of Canine Distemper
Virus Nucleocapsid Protein Gene in Canine Peripheral Blood
Mononuclear Cells by RT-PCR. J. Vet. Med. Sci., 1995, 57, 439-445.
18. — SORJONEN D.C. : Electrophoretic determination of albumin and
gamma globulin concentrations in the cerebrospinal fluid of dogs
with encephalomyelitis attribuable to canine distemper virus infec-
tion : 13 cases (1980-1987). J. Am. Vet. Med. Assoc., 1989, 195,
977-980.
19. — TIPOLD A., PFISTER H. et VANDEVELDE M. : Determination of
the IgG index for the detection of intrathecal immunoglobulin syn-
thesis in dogs using an ELISA. Res. Vet. Sci., 1993, 54, 40-44.
20. — VANDEVELDE M., FANKHAUSER R., KRISTENSEN B. et
KRISTENSEN B. : Immunoglobulins in Demyelinating Lesions in
Canine Distemper encephalitis. Acta Neuropathol., 1981, 54, 31-41.
21. — WATSON A.D.J. et WRIGHT R.G. : The ultrastructure of
Cytoplasmic Inclusions in Circulating Lymphocytes in Canine
Distemper. Res. Vet. Sci., 1974, 17, 188-192.
22. — WATSON A.D.J. et WRIGHT R.G. : The ultrastructure of inclusions
in blood cells of dogs with Distemper. J. Comp. Path., 1974, 84,
417-427.
23. — WINTERS K.A., MATHES L.E., KRAKOWKA S. et OLSEN R.G. :
Immunoglobulin class response to canine distemper virus in gnoto-
biotic dogs. Vet. Immunol. Immunopathol., 1983, 5, 209-215.
Revue Méd. Vét., 2000, 151, 2, 157-161
CHOIX RAISONNÉ DES EXAMENS COMPLÉMENTAIRES À EFFECTUER LORS DE SUSPICION DE MALADIE DE CARRÉ 161
 6
6
1
/
6
100%