BIOLOGIE CELLULAIRE VEGETALE

Biologiecellulairevégétale–Lecytosquelettedeseucaryotes|1
BIOLOGIECELLULAIREVEGETALE
LECYTOSQUELETTEDESEUCARYOTES
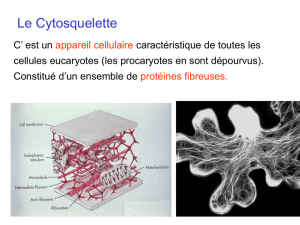
Lecytosqueletteestunestructureconstituéepardesfilamentsnonspécifiques(communsàtoutesles
cellules),desmicrofilamentsd’actine,desfilamentsintermédiairesspécifiquesdecertainescellules(GFAP,Glial
Fibrillary,AcidicProtein=Protéineacidedescellulesgliales;cytokératinedestissusépithéliaux,
neurofilamentsdestissusnerveux),etdesmicrotubulesformésdetubulinealphaetbeta.
Touscesélémentsn’ontpasuniquementunrôledesquelette:enassociationavecd’autresprotéines,ils
assumentd’autresfonctions,tellesquelesmouvementsdedéplacement,etilspossèdentdesfacultéstrès
importantesd’adaptation.
Lesmicrofilamentsd’actinedetrouventàlapériphériedescelluleseucaryotes,lesmicrotubulesontune
dispositionradiaireàl’intérieurdelacelluleetlesfilamentsintermédiairessontdesstructuresquipermettent
lesjonctionsavecd’autrescellules(doc.1).
Toutescessous‐unitésdonnentdespolymèresrendusvisiblesdanslescellules.
Danslescellulesanimalesonpeuttrouverdelavimentinequiestunemoléculefilamenteuseintermédiaire,
caractéristiquedescellulesd’originemésenchymateuse(doc.2b).
Danslescellulesvégétales(doc.2c)onpeutobserverlescellulesàdifférentsstadeducyclecellulairegrâceà
l’organisationdesmicrotubulesquidiffèreselonlestadeducycle.EnfaisantunecoupeenZonpeutalors
observerdescellulesdansdesstadesdifférents.
LESTUBULINESETLEURSPROTEINESASSOCIEES
LAFAMILLEDESTUBULINES
Ilexisteplusieurstypesdetubulines:α,β,γ,δ,ε,ζ,ηclassésselonleurshomologiesdeséquence.Onpeut
fairedescomparaisonsdetubulines.
Lesmicrotubulessontconstituésessentiellementdetubulinesαetβ.Lesautresfamillesdetubulinessont
distribuéesdanslescellulesspécifiquesousituéesdansdesrégionsspécifiquescommepourlatubulineγque
l’onretrouvedanslescentrosomesdescelluleseucaryotes.
FtsZestl’ancêtredestubulines,c’estleprécurseurcapabledeformerdespolymèressousformefilamenteuse
commedesmicrotubules.
Auseindestubulinesαetβilyaunnombrevariabledegènesavecdesvariationsisotypiques:chezl’homme
parexempleilya8gènesd’α‐tubulineet5gènesdeβ‐tubuline.
Ilexistesixclassesdeβ‐tubulinequidiffèrentpardesmutationsponctuellesd’acidesaminés:
- ClasseIetIVb:expressionconstitutive;
- ClasseII:prédominantedanslecerveau,lescellulesnormalesettumoralesmammaires;
- ClasseIII,IvaetVI:variablesaucoursdudéveloppementetprédominantesdanslescellules
cancéreuses;
- ClasseV:excluelesneurones.
Selonlescellules,d’autrestubulinesprennentlerelai.
Lestubulinessontconstituéesd’unesuccessiondefeuilletsβetd’hélicesα.

Biologiecellulairevégétale–Lecytosquelettedeseucaryotes|2
Dansuneexpériencedemodulationintrinsèquedeladynamiquedesmicrotubulesselonleurcomposition
isotypique,onconstatequedansundimèreαβdetubuline,lamodificationdelasous‐unitéβinduitune
modificationdelavitesseintrinsèquedecroissancedupolymère.
LESMAPSSTRUCTURALES
Letissucérébralestricheentubuline(20mg/ml)quisedépolymériselorsdelacentrifugation.Dansle
surnageantSonséparelesprotéinessolubles,dansleculotConséparelesdébriscellulairesetlesprotéines
membranaires.Onchauffepuisoncentrifugepouréliminerlesprotéinessolublesavantdeporterlemélangeà
froidpourdépolymériserlesmicrotubules.Enrépétanttroisfoiscesétapes,lestubulinesseséparentlorsde
l’électrophorèse.Maislesfacteursprotéiquesrestentassociésauxmicrotubulesmalgrélescentrifugations.Ils
ontunhautpoidsmoléculaire.
Onpeutséparerlesfacteursprotéiquesassociésauxmicrotubules(MAPs)etdoncpurifierlestubulinessurune
colonneéchangeused’anionscarlesmicrotubulesrestentpluslongtempsfixésàlacolonnequelesMAPs:
élutiondestubulinesà0,7MdeNaCl/élutiondesMAPsde0,15à0,45MdeNaCl.
AssemblagedetubulineinvitroenprésencedeMAPs:
Audessusdelaconcentrationcritiqueilyacroissanceetformationdepolymèresdetubulines,endessousde
cetteconcentrationilyadépolymérisationdespolymères.Lorsqu’onajoutedesMAPs,onconstatequela
concentrationcritiquebaisse,cequisignifiequelesMAPsfavorisentlapolymérisationdesmicrotubuleset
stabilisentlespolymèresparpontage.
Ex:MAP65(65kD)uniquementdanslescellulesvégétales;MAPUuniverselledescelluleseucaryotes.Ilyaun
paneldeprotéinesconnuesspécifiquesd’unecelluleparticulière,d’unorganismeoutotalementubiquitaire.
IlyaformationdeliensréguliersentrelestubulinesparlesMAPs,lesmicrotubulesnesontpascollés.
SYNTHESEDESDIMERESDETUBULINE
Lesdimèresdesous‐unitésα/βsontvéhiculéspardesfacteursd’assemblage.αetβsonttoujoursassociésà
unouplusieurscofacteurspermettantl’associationdecesdeuxsous‐unitéspourlibérerdemanièresoluble
uniquementdesdimères.Ilyaaumoinscinqfacteursd’assemblagedesdimèresα/β.
SITESDENUCLEATIONDESPOLYMERES
Lanucléationetl’élongationdesmicrotubulessefontàpartirducentrosomelorsdel’interphase.Celaaété
observégrâceàlafusiondelapartiecodantedugènedelatubulineavecduGFP.
TouteslesMAPsselientauxmicrotubules,ellespossèdenttouteslaséquenceMBDquireconnaitlatubuline.
OnpeutalorsfusionnerlaséquenceMBDavecduGFPpourobserverlanucléation.
Structureducentrosomedanslescellulesanimales:
Ilyadeuxcentriolesconstituésdeneuftripletsdemicrotubulesetunezonepéricentriolairequipossèdele
sited’initiationdesmicrotubules.Danslecentrosomeontrouvedelatubulineγetdanslesfuseauxmitotiques
ontrouvedelatubulineα.
Chezleschampignonsilyadeuxzonesdemodificationdedensitédel’environnementnucléairequi
correspondentàdescorpspolaires.

Biologiecellulairevégétale–Lecytosquelettedeseucaryotes|3
Danslescellulesvégétalesiln’yapasdestructureparticulièreetpourtantilyadesmicrotubules.Auniveaude
l’ensembledelasurfacedunoyau,ontrouvedelaγ‐tubulinequipourraitprovenirdeladispersiondescentres
organisateurs/initiateursdelapolymérisationdesmicrotubules.
LESCOMPLEXESDENUCLEATION
Lecomplexedenucléationestconstituédedeuxcomplexesdistincts:lespetitscomplexes(complexe
nucléateurminimal=gamma‐TubulinSmallComplex)sontconstituésdeγ‐tubuline,deGCP2etdeGCP3etils
sontliésàuneextrémitédesmicrotubules;legrandcomplexe(complexedenucléation=gamma‐TubulinRing
Complex)estconstituédeGCP4,GCP5etGCP6etilestfixéauxpetitscomplexes.
Chezleslevuresilyauniquementlepetitcomplexealorsquechezleseucaryotesontrouvetoutesles
protéinesdugrandcomplexe.
LesmicrotubulespolymérisentàpartirdecentresorganisateursMTOC:chezlesplantesilyadelaγ‐tubuline
autourdunoyauetdisperséeenpériphérie,danslescellulesanimaleslecentreinitiateurestlocalisédansle
centrosome.
LECYTOQUELETTED’ACTINEETSESMOTEURSASSOCIES
ASSEMBLAGEPOLARISEDEMONOMERESD’ACTINE
L’actines’auto‐assembleàl’aided’unesériederéactionsbimoléculaires.Lesfilamentsd’actinesefontetse
défontparadjonctionetdisjonctiondesous‐unitésauxdeuxextrémitésdupolymère.Lesréactionsauxdeux
extrémitésontdesconstantesdevitessedifférentes.L’associationdessous‐unitéss’effectuerapidementaux
deuxextrémités.Ladissociationdessous‐unitésestrelativementlenteauxdeuxextrémités.
L’extrémitélaplusdynamiqueestassociéeàlamyosine.
LOCALISATIONCELLULAIRE
Lescâblesd’actinesontbienrigides.
Chezlalevure,lesfilamentsd’actineformentdespolymèresfilamenteuxenagrégatsponctués;dansles
cellulesanimales,lesfilamentsd’actinesontprésentsàlapériphériedelacelluleennes’associentpasen
faisceauxparallèles;danslescellulesvégétalesonpeutobserverquelesfilamentsd’actinesontlocalisésaux
endroitsoùilsn’yapasdemicrotubules.
Pourobserverlesfilamentsd’actine,onpeutréaliserunimmunomarquageanti‐actinepardel’orcolloïdal.
Larhodaminephalloïdinepossèdeuneforteaffinitépourlesfilamentsd’actinemaisbloqueleurdynamique.
Elleestutiliséepourleurcolorationrouge.
Danslescellulesvégétales,laséparationdescellulesfillesentélophasesefaitgrâceauxfilamentsd’actine;
danslescellulesanimalesleurorientationestdifférenteencytocinèse,ilssontorganisésenanneaux
contractilesperpendiculairementauxmicrotubulesetlacontractionestréaliséegrâceauxmicrofilamentsde
myosine(commepourlacontractionmusculaire).

Biologiecellulairevégétale–Lecytosquelettedeseucaryotes|4
LESPROTEINESMOTRICESLIANTL’ACTINE
Lesprotéinesmotricesliantl’actinepeuventêtrelamyosineoulaminimyosine.Ellesréalisentdesmicro‐
contractionspardéplacementdelatêtecatalytiquedelamyosinesurunelocalisationparticulièredufilament
d’actinegrâceàl’hydrolysedel’ATPenADP.Ilyauneforteinteractionentrelamyosineetl’actineenprésence
d’ADPalorsqu’ilyadissociationlorsquelatêtecatalytiquefixedel’ATP.
Ilexistedeuxclassesdemyosinebiencaractériséeschezlesplantes:
- LesmyosinesII(lesplusconventionnelles)induisentundéplacementdesfilamentsd’actinedu+vers
le‐;
- LesmyosinesIdéplacentdesvésiculeslelongd’unfilamentd’actineversl’extrémité+,maiselles
peuventaussiêtreresponsabledudéplacementdesfilamentsd’actinedanslacellulelorsqu’ellessont
fixéesàlamembrane.
AUTRESPROTEINESASSOCIEESAL’ACTINE
- Fimbrine:monomèrequipermetl’associationoulaformationdefaisceaux(enfaisantdes«ponts»);
- α‐actinine:multimèrepermettantégalementl’associationoulaformationdefaisceaux;
- tropomyosine:joueunrôledanslacontractionmusculaire;
- filamine:dimèrepermettantlaformationderéseauentrecroisé;
- gelsoline:fragmentel’actine;
- profiline:inhibel’associationenpolymèredessous‐unitésdel’actine(pendantletransportdel’actine
danslecytosolparexemple).
EFFETSDEDROGUESSURLECYTOSQUELETTED’ACTINEDESCELLULESANIMALES
Larhodaminephalloïdinerévèlel’actinepériphériquealorsquelacytochalasineBoulalatrunalinerévèlent
lesstructuresponctuéesoulesfilamentsd’actineaumomentdelatélophasedanslescellules.
L’actinesedépolymérisedanslescellulesanimalesaucoursdelamitose,ellen’estprésentequ’eninterphase
etentélophase.Danslescellulesvégétales,lesfilamentsd’actinesontconstammentprésents.
ACTINEETMOTILITECELLULAIREDELACELLULEANIMALE
LecomplexeARP2/3permetl’organisationramifiéedespolymèresdanslecortex.Aumilieudelacellule,les
filamentsd’actinesontdépolymérisés,lesmonomèressonttransportésverslamembraneplasmiquegrâceàla
profilinequiinhibeleurréassociation.Cesréactionssontduesàunstimulusextracellulaireetlapolymérisation
dufilamentd’actineprèsdelamembraneplasmiquepermetàcelle‐cid’êtrepousséeversl’extérieur.

Biologiecellulairevégétale–Lecytosquelettedeseucaryotes|5
LESFILAMENTSINTERMEDIAIRES
Lesfilamentsintermédiairessontdespolymèresflexiblesmaisrésistantsquifournissentunsupport
mécaniqueauxcellules,enprévenantenparticulierl’étirementexcessifdescellulesdanslestissusdes
organismessupérieurs.
ORGANISATIONDESPOLYMERES
Lesfilamentsintermédiairesontundiamètrede10nmenmoyenneetprésententjusqu’à16
superenroulementssurunecoupetransversale.Ilssontconstituésdedimèresmoléculairesantiparallèlesà
quatrechaines,nonpolaires;c’estpourquoilesfilamentsintermédiairessontgénéralementconsidérés
commeétantapolaires.
ASSEMBLAGEDEPOLYMERES
Lessous‐unitéssolublesdefilamentsintermédiairesdissociéss’auto‐assemblentspontanémentenstructure
ressemblantàdesfilamentsintermédiaires,enquelquesminutesdanslesconditionsphysiologiquesinvitro.
L’assemblageesthautementfavorisé,àenjugerparlafaibleconcentrationcritique.Lessous‐unitéss’ajoutent
àlafoisauxextrémitésetsurlescôtésdupolymère,contrairementauxfilamentsd’actineetauxmicrotubules
quines’allongentqu’àleursextrémités.
CLASSIFICATIONDESFILAMENTSINTERMEDIAIRES
Ilssontclassésencinqcatégories.Ilspossèdentdeshomologiesdeséquencesmaissontconstituésde
différentscomposantspeptidiquesetsontlocalisésàdifférentsendroits.
STRUCTUREMOLECULAIRECOMPARABLEDESFILAMENTSINTERMEDIAIRES
Ilspossèdenttousundomainecentralidentique,lesblocsmonomériquespossèdentuneorganisation
tridimensionnelleprochemaisleurdomaineNetC‐termsontdifférents.
- Leskératines(typeI):lescytokératinessontprésentesdans95%desprotéinesdel’épiderme.Elles
jouentunrôledanslacohésionetlemaintiendel’intégritédestissusépithéliaux.Cesontdes
polymèresformésd’unevingtainedesous‐unitésacideetbasiquequiformentdesdimèrespuisdes
tétramères.
- Lesvimentines(typeII):enmitoseilyadépolymérisationdesfilamentsintermédiairesetlessous‐
unitésonttendanceàs’agréger.
- Lesneurofilaments(typeIII):présentsdanslesneurones,ilssonttransportésparunmouvement
antérogradeversl’extrémitédel’axone.
- Leslamines(typeIV):ilssetrouventàlasurfacedesnoyaux.Ellessontimpliquéesdanslaformedu
noyau,dansl’organisationspatialedesporesnucléaires,danslarégulationdelatranscription,dansla
réplicationdel’ADN,dansl’ancragedelachromatineinterphasique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%