Possibilités de traitement chirurgical des anévrismes et

CURRICULUM Forum Med Suisse No3 15 janvier 2003 39
Introduction
Les pathologies de l’aorte sont fréquentes, et
très importantes en raison du grand risque de
complications aiguës et potentiellement fatales.
Pour les diagnostiquer à temps, le problème est
que la plupart de ces pathologies aortiques res-
tent longtemps asymptomatiques, à l’exception
des dissections aiguës et des lésions trauma-
tiques.
Et si les signes annonciateurs de complications
se manifestent, ils sont souvent aspécifiques et
difficiles à classer. Ce qui impose donc de faire
un diagnostic différentiel dès la moindre suspi-
cion de pathologie aortique.
De plus, les patients présentant des pathologies
cardiovasculaires avec risque d’anévrisme aor-
tique (hypertension artérielle, sténose aortique
avec valve aortique bicuspide, status après trai-
tement d’anévrismes d’autres localisations ou
anamnèse familiale de pathologies aortiques)
doivent faire l’objet d’un screening de l’aorte
thoracique.
Cet article donne un aperçu des deux patho-
logies les plus courantes de l’aorte thoracique,
l’anévrisme et la dissection, et présente leurs
particularités cliniques, thérapeutiques et pro-
nostiques.
L’aorte est un organe qui s’étend de la valve aor-
tique jusqu’à la bifurcation iliaque, divisé en
plusieurs segments: le premier segment, de
l’anneau valvulaire à la ligne sinotubulaire, est
la portion sinusale, formée par le sinus de Val-
salva. Il donne comme premières ramifications
les artères coronaires. La portion sinusale avec
la valve aortique est également appelée racine
aortique. La ligne sinotubulaire, au niveau des
insertions des commissures valvulaires aor-
tiques, marque la transition entre portion sinu-
sale et aorte ascendante. L’aorte ascendante va
jusqu’au niveau du tronc brachiocéphalique,
première ramification de la crosse aortique en
caractérisant sa partie proximale. L’arc aor-
tique donne ensuite la carotide primitive et
l’artère sous-clavière gauche. Vient ensuite le
segment dit isthmique, qui va jusqu’au canal ou
au ligament artériel de Botal, qui forme le seg-
ment proximal de l’aorte thoracique descen-
dante. Il est suivi du segment thoraco-abdomi-
nal, jusqu’au diaphragme, et du segment ab-
dominal, rétropéritonéal. La longueur normale
de l’aorte n’est en corrélation ni avec la taille ni
avec le poids, mais bien avec l’âge et le sexe,
l’aorte augmentant en longueur avec l’âge (env.
0,005–8 cm/an); les femmes ont des aortes plus
fines que les hommes, à taille égale. Chez les
adultes, le diamètre normal au niveau de la
ligne sinotubulaire est de 21 mm [1], celui de
l’aorte ascendante de 32 mm, de l’aorte pro-
ximale de 30 mm, de l’aorte thoraco-abdomi-
nale de 26–28 mm et de l’aorte infrarénale de
19 mm [2].
Anévrismes aortiques
thoraciques
Si le diamètre de l’aorte est supérieur à sa
norme, et si toutes les couches de la paroi sont
impliquées, il s’agit d’un anévrisme vrai. L’in-
cidence des anévrismes thoraciques est de
5,9/100000/habitants/an, dont 50% au niveau
de l’aorte ascendante (figure 1), 11% au niveau
de la crosse aortique et 38% au niveau de l’aorte
descendante [3]. 25% sont associés à un ané-
vrisme de l’aorte abdominale, et 12,5% pré-
sentent plusieurs dilatations anévrismales [4].
Il est donc vivement recommandé de toujours
examiner l’aorte sur tout son trajet. Pour dé-
crire l’extension des anévrismes thoraciques,
il est possible de faire appel à la classification
internationale selon Crawford (figure 2) [5].
Les hommes sont plus souvent touchés par des
anévrismes aortiques que les femmes, selon des
proportions de 2:1 à 9:1 [6], et en Grande-Bre-
tagne, 1,2% des hommes et 0,6% des femmes
décèdent d’anévrismes aortiques (National
Center for Health Statistics 1987). L’étiologie est
la plupart du temps artériosclérotique, avec dé-
générescence de la média, mais aussi faiblesse
du tissu conjonctif (syndrome de Marfan sur-
tout), et plus rarement aortite et nécrose kysti-
que de la média. Il existe de rares formes
familiales [7, 8]. Les facteurs de risque des
anévrismes sont l’hypertension artérielle, l’âge,
le sexe masculin et la consommation de tabac.
Possibilités de traitement chirurgical
des anévrismes et dissections
aortiques thoraciques
P. A. Berdat, J. Schmidli, T. Carrel
Service de Chirurgie cardiovas-
culaire, Hôpital de l’Ile, Berne
Correspondance:
Dr P. A. Berdat
Service de Chirurgie
cardiovasculaire
Hôpital de l’Ile
CH-3010 Berne

CURRICULUM Forum Med Suisse No3 15 janvier 2003 40
L’évolution spontanée d’un anévrisme est ca-
ractérisée par son augmentation de volume et
la manifestation de complications à long terme,
notamment la rupture et la dissection. La rapi-
dité de la progression est fonction des dimen-
sions de l’anévrisme, les plus petits se dévelop-
pant plus lentement et les plus grands plus
rapidement. Ce phénomène, suivant la loi de
Laplace, résulte de l’augmentation de la tension
de la paroi surproportionnelle par rapport au
viduel de rupture peut se calculer selon la for-
mule de Juvonen [20]. L’hypertension artérielle
et la BPCO sont des facteurs de risque de rup-
ture. L’indication opératoire est posée dès que
le segment atteint dépasse le double de son
diamètre normal. Ce qui veut dire à partir de
6 cm pour l’aorte thoracique [9, 23, 24] et de
5 cm pour l’aorte infrarénale, car à partir de
tels diamètres, le risque de rupture est très
nettement plus élevé que le risque périopéra-
toire [25]. Chez les patients ayant un Marfan,
une stratégie thérapeutique plus agressive est
indiquée en raison du risque accru de dissec-
tion et de rupture, et de la progression plus
rapide, c’est-à-dire qu’un remplacement aor-
tique est indiqué déjà à partir de 5 cm pour
l’aorte thoracique. En plus du diamètre, il faut
tenir compte également de la rapidité de l’évo-
lution et de la symptomatologie dans la pose de
l’indication: un traitement chirurgical doit être
prévu électivement pour des progressions de
plus de 6–10 mm par an [26], et plus tôt pour
celles de plus de 10 mm. La technique diag-
nostique de choix est l’angio-TC ou l’angio-
IRM du thorax et de l’abdomen/bassin. Si la
fonction rénale est diminuée, il faut donner la
préférence à l’IRM du fait qu’elle mieux tolérée
que la TC.
75% des anévrismes aortiques sont asympto-
diamètre. Des études ont donné des progres-
sions d’env. 0,1–0,56 cm par an [9–18]. A long
terme, 44–51% des anévrismes thoraciques
évoluent vers la rupture (figure 3) [3, 18], et à
partir d’un diamètre de 5 cm, le risque de rup-
ture est nettement augmenté. Avec un diamètre
de 6 cm, l’incidence annuelle des ruptures est
de 3–7% [18, 19], celle de dissection et de rup-
ture cumulée de 6,9% et celle des décès de
11,8% [18]. La survie spontanée avec des
anévrismes de cette taille est donc mauvaise,
avec 24% à 2 ans, et le décès résulte d’une rup-
ture dans 50% des cas [21, 22]. Le risque indi-
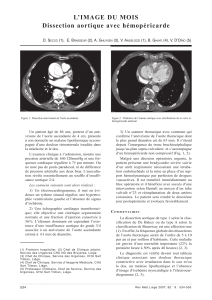
Figure 1.
Vue peropératoire d’un anévrisme
de l’aorte ascendante (A).
Figure 2.
Classification des anévrismes de
l’aorte thoraco-abdominale selon
Crawford: a) type I; b) type II;
c) type III; d) type IV.
Figure 3.
TC d’une rupture anévrismale
de l’aorte ascendante (A) avec
hématome médiastinal et extra-
pleural et (B) atélectasie par
compression du poumon gauche.

CURRICULUM Forum Med Suisse No3 15 janvier 2003 41
matiques et découverts fortuitement. S’il y a des
symptômes, il faut soigneusement préciser s’ils
peuvent être ceux de l’anévrisme, car un ané-
vrisme symptomatique a un pronostic nette-
ment moins bon si le patient ne bénéficie pas
très rapidement d’un traitement chirurgical.
Le symptôme dominant est la plupart du temps
la douleur, paravertébrale (interscapulaire à
lombaire basse), rarement rétrosternale, abdo-
minale ou sacrée, qui a souvent un caractère
sourd. Les douleurs purement abdominales
sont extrêmement rares. Les anévrismes très
volumineux peuvent provoquer des phéno-
mènes de compression des organes internes,
comme dysphagie par compression œsopha-
gienne, stase jugulaire par compression de la
veine cave supérieure pour les volumineux
anévrismes de l’aorte ascendante, pneumonies
récidivantes par compression bronchique et
même ballonnements par compression de vis-
cères, tout comme enrouement si atteinte du
nerf vague ou du récurrent. La pression per-
manente peut éroder les structures voisines et
former des fistules aortobronchiques ou aor-
toœsophagiennes. Ce n’est alors souvent que
l’hémorragie dans les organes creux qui met en
route les moyens diagnostiques. Si l’indication
à un traitement chirurgical est donnée, il faut
aller plus loin dans le diagnostic: en raison du
stress considérable pour le système cardiovas-
culaire en cours d’intervention. Il convient de
procéder à un examen de la fonction cardiaque
et rechercher une cardiopathie coronaire ou
des valvulopathies majeures. Une échocardio-
graphie, mais aussi un cathétérisme cardiaque
sont très souvent requis. Il s’agit en outre d’ex-
clure des sténoses carotidiennes par ultrasono-
graphie Duplex, et des artères périphériques
par examen sous occlusion. Un examen de la
fonction pulmonaire est indiqué en préopéra-
toire chez les patients devant subir une thora-
cotomie ou souffrant d’une grave pathologie
pulmonaire. La fonction rénale doit également
être examinée.
La plupart des interventions sur l’aorte thora-
cique se font sous circulation extracorporelle
(CEC). Pour les interventions proches du cœur,
elle permet une mise en arrêt du cœur. Lors du
remplacement de l’aorte descendante, la CEC se
fait à cœur battant et est raccordée aux vaisseaux
iliaques. Ce qui permet d’optimiser le manage-
ment cardiovasculaire, et surtout le contrôle de
la postcharge au moment du clampage du seg-
ment aortique à remplacer, vu que l’ascension
brusque de la postcharge fait courir le risque
d’ischémie myocardique peropératoire. La CEC
permet en outre de maintenir la perfusion vis-
cérale et spinale, en perfusant l’aorte distale, et
de protéger de l’ischémie les organes internes
par abaissement de la température corporelle
centrale à 32° env. (hypothermie modérée), ce
qui diminue leur consommation d’oxygène.
En présence d’un anévrisme de la racine aorti-
que avec dilation de l’anneau valvulaire et de
la portion sinusale, il s’agit d’une ectasie an-
nulo-aortique (EAA, figure 4a, b). En général,
la dilatation de la ligne sinotubulaire que cela
implique, avec écartement des commissures
valvulaires aortiques, provoque une insuffisance
aortique centrale par impossibilité de coapta-
tion des valvules. L’indication opératoire est
donnée par la gravité de l’insuffisance aortique
et de la dilatation. Avec un diamètre de la ra-
cine aortique de plus de 5 cm, le risque de rup-
ture ou de dissection augmente considérable-
ment. L’EAA est souvent associée à un syn-
drome de Marfan, à des anomalies valvulaires
aortiques et à un syndrome de coarctation. Les
symptômes cliniques sont dominés par des pré-
cordialgies et des signes d’insuffisance aor-
tique. Le diagnostic est posé de préférence par
TTE (échographie transœsophagienne) mais
aussi par angio-TC ou IRM.
Si un ou plusieurs sinus de Valsalva sont dila-
tés, il s’agit d’un anévrisme sinusal. Si la valve
aortique est normale, il est possible de rempla-
cer la racine aortique en conservant la valve
aortique native [27] et de ne remplacer que les
sinus dilatés et l’aorte ascendante. L’EAA et les
anévrismes de l’aorte ascendante s’opèrent par
sternotomie. L’EAA avec valvulopathie impose
généralement le remplacement de la racine
aortique avec la valve par «composite graft»,
avec valve mécanique ou biologique, ou par
homogreffe. Chez les adolescents et jeunes
adultes, il est possible en alternative de procé-
der à l’opération dite de Ross: transfert de la
valve pulmonaire en position aortique avec
reconstruction de la sortie du ventricule droit
par un conduit biologique avec valvule. Si la
valve aortique est intacte, il est possible d’en-
visager l’opération de Yacoub [28] (figure 4) ou
de David [29, 30], avec sauvegarde de la valve.
Mais quelle que soit la technique, les ostia
coronaires doivent être réimplantés. Le princi-
pal avantage du remplacement de la racine en
gardant la valve ou en transférant la valve pul-
monaire est l’absence d’une anticoagulation à
vie. Lors de la correction d’un anévrisme isolé
de l’aorte ascendante, il faut implanter une pro-
thèse supracoronaire. Les anévrismes de la
crosse peuvent être abordés par sternotomie ou
par thoracotomie latérale, surtout lors de loca-
lisation distale. Seule une partie peut être rem-
placée si nécessaire, ou l’ensemble de l’arc avec
réimplantation des branches supra-aortiques
en manchette. S’il y a une pathologie du seg-
ment aortique voisin, qui devra probablement
être opéré plus tard, il est possible de mettre un
«elephant trunk» à titre préparatoire [31, 32].
Cette trompe d’éléphant pourra alors directe-
ment être utilisée pour remplacer le reste de
l’aorte, ce qui simplifiera considérablement la
seconde intervention. Après interventions sur

CURRICULUM Forum Med Suisse No3 15 janvier 2003 42
la racine de l’aorte, l’aorte ascendante et la
crosse aortique, il faut compter une mortalité
postopératoire immédiate de 1–7%, une inci-
dence d’infarctus de 3,5% et de déficits neuro-
logiques de 1–3%, dont 50% de nature transi-
toire. Les anévrismes de l’aorte descendante
sont remplacés par une prothèse par thoraco-
tomie gauche postérolatérale. En cas d’exten-
sion abdominale, d’anévrismes dits thoraco-
abdominaux, l’abord est élargi distalement par
thoraco-phrénico-lombotomie, pour permettre
de remplacer tout le segment anévrismal en ré-
implantant les artères intercostales distales
(D8–D12), de même que les artères viscérales.
Avec la réimplantation des artères intercostales
distales, le risque de paraplégie par ischémie
spinale devrait être diminué, car la perfusion
médullaire peut dépendre en majeure partie de
ce segment. La protection médullaire peut en
outre être complétée par un drainage périopé-
ratoire du liquide céphalorachidien. Pour pré-
venir les éventuelles complications ischémi-
ques, les artères viscérales et rénales sont per-
fusées continuellement par des cathéters sélec-
tifs branchés sur la CEC [33–35]. Le manage-
ment de l’anesthésie comporte en plus un tube
à double lumière, pour permettre la ventilation
d’un seul poumon. La mortalité postopératoire
immédiate de ces interventions est de 3–12%,
et les complications sont les infarctus du myo-
carde périopératoires (2%), les complications
cérébrales (0,5%), paraplégies (4–7%), compli-
cations respiratoires (jusqu’à 43%) et l’insuffi-
sance rénale (7%). Le remplacement de l’aorte
thoraco-abdominale est globalement grevé de
davantage de complications que celui de l’aorte
thoracique descendante seule. De manière
générale, dans les dernières séries publiées,
les complications graves sont en diminution
[36–39]. Malgré tout, la paraplégie et la para-
parésie restent les complications postopéra-
toires les plus redoutées. Ce risque doit donc
être évalué en préopératoire et discuté avec le
patient. Il dépend d’une part de l’importance de
l’anévrisme, les anévrismes Crawford de type
II faisant courir un risque de paraplégie de
31% et ceux de type I de 15%, chiffres les plus
élevés, alors que ceux de type III et IV présen-
tent un risque plus faible, resp. de 7% et 4%
[38]. D’autres facteurs de risque de paraplégie
sont l’étendue du remplacement aortique, la
durée du clampage aortique, la présence d’une
rupture aortique, l’âge, un autre anévrisme de
l’aorte ascendante ou de l’arc, et une insuffi-
sance rénale préopératoire. Mais l’incidence
des paraplégies peut être abaissée par des
mesures périopératoires, dont: le recours à la
CEC sous hypothermie modérée pour la perfu-
sion de la partie distale du corps, sous clam-
page de l’aorte proximale, la réimplantation
des artères intercostales D8–D12, le drainage
du liquide céphalorachidien, des durées de
clampage les plus brèves possibles, la préven-
tion de phases prolongées d’hypotension, et le
recours à plusieurs médicaments (thiopental,
stéroïdes, prostaglandines, papavérine). Au-
cune de ces mesures à elle seule n’a fait la
preuve flagrante de son efficacité, mais plu-
sieurs études cliniques ont pu démontrer une
diminution de la fréquence des paraplégies lors
de leur association judicieuse [36, 37, 40–45].
Dans notre collectif mixte d’anévrismes et de
dissections, l’incidence des paraplégies a pu
être abaissée de manière significative, de 8,8%
à 2,6% [46, 47]. Dans une étude prospective
randomisée sur la technique du drainage du
liquide céphalorachidien, 3 mois après l’opé-
ration, 7% des patients étaient encore para-
plégiques et 7% paraparétiques (dont les 2⁄3
étaient néanmoins capables de marcher) [48].
L’insuffisance rénale postopératoire a elle aussi
un effet négatif non négligeable sur le pronos-
tic à long terme. Svensson et al. [35] ont pu
montrer que la survie à 5 ans de patients en in-
suffisance rénale à dialyser ou non en postopé-
ratoire, avec respectivement 7% et 49%, est
significativement moins bonne que celle des
patients sans insuffisance rénale, de 69%. Les
facteurs de risque d’insuffisance rénale post-
opératoire sont l’âge, le sexe masculin, des
troubles de la perfusion et de la fonction rénale
préopératoires, un status après accident céré-
brovasculaire et la durée de l’ischémie rénale
peropératoire. Les complications respiratoires
sont fréquentes du fait qu’il s’agit souvent de pa-
tients fumeurs ayant une BPCO, mais contrai-
rement à l’insuffisance rénale, elles n’ont aucune
répercussion sur le pronostic à long terme.
Dans des situations choisies, l’anévrisme peut
être exclu par un stent intra-aortique (figure 5)
[49–56]. Ce stent est mis en place sous contrôle
endoscopique par voie fémorale ou iliaque. Il
existe en outre des techniques hybrides [57,
58], chirurgicales et interventionnelles.
Figure 4.
Vue peropératoire du remplace-
ment de la racine aortique avec
conservation de la valve aortique
(*) selon Yacoub; (<) ostium
et pas encore réimplanté
de la coronaire droite.

CURRICULUM Forum Med Suisse No3 15 janvier 2003 43
Les premiers résultats de ces méthodes sont
encourageants, leurs complications sont nette-
ment moins nombreuses que celles des tech-
niques chirurgicales ouvertes, surtout en ur-
gence. Mais il reste encore plusieurs problèmes
à long terme, comme la persistance ou l’appa-
rition d’«endoleaks», la migration du stent et
la réaction à long terme du matériel.
Dissection aortique
La dissection aortique (figure 6a, b) est définie
par une infiltration de la média par du sang
extraluminal dans la paroi aortique. Physio-
pathologiquement, il se produit une déchirure
de l’intima avec infiltration de sang dans la
média, pouvant s’étendre aussi bien de façon
antérograde que rétrograde en direction proxi-
male. La dissection provient rarement d’un
hématome intramural de la paroi aortique,
sans déchirure intimale [59, 60]. L’infiltration
de sang produit en peu de temps une seconde
lumière perfusée, ou fausse lumière, qui s’étend
rapidement et peut comprimer la vraie lumière
au point de donner un gradient de pression
hémodynamiquement significatif entre les moi-
tiés supérieure et inférieure du corps (pseudo-
coarctation). Sous l’effet des multiples fissures
de la membrane entre la vraie et la fausse lu-
mière, plusieurs interconnections se forment
entre ces deux lumières, appelées «entries» et
«re-entries». La dissection compromet la cir-
culation dans les artères partant du segment
touché par différents mécanismes: déchirure
de la paroi de la vraie lumière de l’artère et per-
fusion uniquement par la fausse lumière, com-
pression par la fausse lumière sous pression,
progression de la dissection dans la branche
artérielle, ou formation de «flaps» intimaux à
l’origine de l’artère, le tout pouvant entraîner
une malperfusion avec ischémie d’organes. La
dissection affaiblit la paroi aortique, ce qui
favorise en phase aiguë la rupture avec tam-
ponnade péricardique, exsanguination interne
et décès, et en phase chronique la dilatation se-
condaire de l’aorte (figure 7). Les dissections
proximales de type A (v. ci-dessous), ont sou-
vent tendance à l’extension rétrograde jusqu’à
la portion sinusale, avec risque d’insuffisance
aortique aiguë, d’occlusion coronaire (surtout
de la droite) ou de pénétration dans le septum
ventriculaire avec bloc AV ou insuffisance mi-
trale aiguë.
Les classifications internationales de Stanford
type A et B (figure 6a, b) [61] ou de DeBakey
type I–IIIb [62] sont utilisées pour décrire dis-
section. Elles tiennent compte de la localisation
de la déchirure intimale initiale et de l’exten-
sion distale de la dissection. La classification
simple de Stanford donne immédiatement le
management thérapeutique, les dissections de
type A avec implication de l’aorte ascendante
et/ou de l’arc aortique proximal doivent être
traitées par une opération en urgence, et les
dissections de type B limitées à l’aorte thora-
cique descendante généralement de manière
conservative.
L’incidence de la dissection aortique n’est pas
précisément connue, mais selon des estima-
tions se basant sur l’incidence des dissections
diagnostiquées, des causes de décès recensées
et de la relation connue entre le nombre des
dissections et des anévrismes avec rupture de
l’aorte abdominale, elle devrait se situer autour
de 10/100000 habitants/an, soit plus fréquente
que la rupture d’un anévrisme de l’aorte abdo-
minale [5]. L’étiologie de la dissection aortique
n’est pas certaine. Les dissections sont cepen-
dant associées dans 75–90% des cas à la né-
crose kystique de la média et à l’hypertension
artérielle. L’athérosclérose par contre n’est
probablement pas impliquée comme facteur
étiologique des dissections, mais tout au plus
dans le cadre de la rupture d’une plaque ul-
cérée pénétrante [60]. Il y a de rares causes
iatrogènes et traumatiques, après cathétérisme
cardiaque par exemple, opérations cardiaques
ou traumatismes par décélération. Les facteurs
de risque d’une dissection sont l’hypertension
artérielle, le syndrome de Marfan et d’autres
syndromes de faiblesse du tissu conjonctif, la
grossesse, des anomalies congénitales de la
valve aortique, la coarctation et l’anévrisme
aortique.
Les dissections au stade aigu déclenchent des
douleurs typiques, telles que douleurs thoraci-
ques foudroyantes, syncopes et valeurs ten-
sionnelles d’hypertension. La douleur est typi-
quement à début rétrosternal dans les dissec-
tions A, interscapulaire dans les B, et elle se
déplace vers la région lombaire. Une sympto-
matologie variable avec variations fugitives du
pouls est elle aussi relativement typique, et
l’absence de pouls est un signe de circulation
compromise et de pronostic très nettement plus
Figure 5.
TC de l’aorte descendante avec
stentgraft (A) in situ.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%