Localisation immunohistochimique dans l`intestin de porc

Article
original
Localisation
immunohistochimique
dans
l’intestin
de
porc
des
composantes
cellulaires
et
humorales
de
la
réponse
immunitaire
M
Olivier
P
Berthon
H
Salmon
1
Équipe
de
«Génétique
et
Immunité»;
2
Équipe
de
«Lymphocytes
et
Immunité des
muqueuses»,
INRA,
laboratoire
de
pathologie
infectieuse
et
immunologie,
centre
de
Tours,
37380
Nouzilly,
France
(Reçu
le
5
mai
1993;
accepté
le
2
décembre
1993)
Résumé ―
L’analyse
des
différentes
composantes
du
système
immunitaire,
cellulaires
et
humo-
rales,
ainsi
que
leurs
localisations,
ont
été
effectuées
sur
coupes
d’intestin
de
porc,
en
utilisant
des
anticorps
spécifiques
des
sous-populations
leucocytaires
porcines.
La
fixation
de
ces
anticorps
a
été
révélée
à
l’aide
d’anticorps
biotinylés
anti-immunoglobulines
de
souris
et
d’un
complexe
révélateur
streptavidine-biotine-péroxydase.
Les
résultats
montrent
une
distribution
spécifique
des
compo-
santes
immunitaires
dans
les
compartiments,
épithélial
d’une
part
et
lamina
propria
d’autre
part.
Dans
l’épithélium,
on
assiste
à
une
prédominance
de
lymphocytes
T
de
phénotype
cytotoxique
(T8),
alors
que
le
tissu
conjonctif
de
la
lamina
propria
est
pourvu
pour
une
moitié
de
lymphocytes
T,
avec
une
légère
prédominance
des
T
auxiliaires
(T4)
sur
les
T
cytotoxiques,
et
pour
l’autre
moitié
de
plas-
mocytes
dont
la
plupart
contiennent
des
IgA.
Les
macrophages
sont
présents
seulement
dans
la
la-
mina
propria.
Les
cellules
épithéliales
des
villosités
et
des
cryptes
expriment
les
antigènes
du
CMH,
de
classe
I sur
la
bordure
en
brosse,
alors
que
ceux
de
classe
Il
sont
présents
uniquement
sur
les
cellules
épithéliales
des
villosités.
En
revanche,
de
même
que
pour
les
IgA,
le
composant
secrétoire
se
localise
sur
les
cellules
épithéliales
du
fond
des
cryptes.
Cette
répartition
suggère
la
possibilité
d’une
réponse
immunitaire
au
niveau
même
de
la
muqueuse
intestinale.
porc
1 lymphocyte
I macrophage
I intestin
1
immunoglobulines
/ entérocytes
Summary ―
lmmunohistochemical
localization
of
the
humoral
and
the
cellular
components
of
the
immune
response
in
swine
gut.
By
immunohistochemistry,
lymphocyte
subsets
of
the
swine
gut
were
localized
either
in
the
epithelium
or
in
the
lamina
propria.
In
addition,
the
distributions
of
class
I
and
class
II
antigens
were
also
characterized,
using
the
streptavidin-biotin-peroxidase
complex
as
the
revelator;
the
endogenous
peroxidase
activity
was
distinguished
from
the
specific
by
cobalt
chloride.
The
results
show
a
compartmentalization
in
the
distribution
of
lymphocytes:
in
the
epithelium,
all
the
cells
were
T
lymphocytes,
the
majority
of
the
CD8
phenotype;
in
contrast,
in
the
la-
mina
propria,
T and
B
cells
were
represented
in
similar
proportions:
T
cells
were
constituted
of
both
CD4
and
CD8
cells
(with
slightly
more
CD4
than
CD8
cells),
while
majority
of
B
cells
harboured
the
IgA
isotype.
Class
I
MHC
was
present
on
epithelium
cells
of
both
the
villi
and
crypts.
In
contrast
MHC
class
//
was
only
present
on
epithelial
cells
of
the
villi.
Both
SC
and
IgA
were
localized
in
the
epithelium
cells
of
the
crypt.
Thus,
this
compartmentalization
suggests
the
possibility
of
an
immune
response
in
the
gut.
pig
/
lymphocyte
/
macrophage
/
intestine
/
immunoglobulins
/
enterocyte
*
Corres
p
ondance
et
tirés
à
p
art

INTRODUCTION
Quelle
que
soit
l’espèce
animale,
la
mu-
queuse
de
l’intestin
grêle
des
Mammifères
est
infiltrée
par
de
nombreuses
cellules
du
système
immunitaire,
en
particulier
des
lymphocytes
et
des
plasmocytes.
Les
lymphocytes
T
sont
présents
dans
l’épithélium
et
dans
la
lamina
propria.
Dans
l’épithélium,
la
majorité
des
lympho-
cytes
T
sont
de
phénotype
T8
chez
l’homme
(Janossy
et al,
1980 ;
Selby
et al,
1983 ;
Cerf-Bensussan
et
al,
1983),
la
souris
(Ernst
et
al,
1986)
et
le
porc
(Bian-
chi
et
al,
1992 ;
Vega-Lopez
et
al,
1993).
Dans
la
lamina
propria,
les
lymphocytes
T4
sont
plus
nombreux
que
les
lympho-
cytes
T8
chez
l’homme
(Selby
et
al,
1983 ;
Cerf-Bensussan
et
al,
1983)
et
le
porc
(Vega-Lopez
et
al,
1993).
Les
lymphocytes
B
et
les
plasmocytes
sont
en
majorité
de
phénotype
immunoglo-
buline
A
(IgA)
dans
la
lamina
propria
de
l’intestin
de
l’homme
(Dobbins,
1986),
de
la
souris
(Mc
Dermott
et
al,
1986)
et
du
porc
(Brown
and
Bourne,
1976 ;
Allen
and
Porter,
1977 ;
Butler
et al,
1981
).
Les
antigènes
du
complexe
majeur
d’histocompatibilité
(CMH)
sont
présents
sur
les
cellules
de
l’épithélium
intestinal.
Les
antigènes
de
classe
1 sont
présents
sur
l’ensemble
des
cellules
l’épithéliales
(Mayrhofer
et al,
1983;
Gorvel
et al,
1984).
Les
antigènes
de
classe
Il
sont
pré-
sents
uniquement
sur
les
cellules
de
l’épi-
thélium
des
villosités
(Wiman
et
al,
1978 ;
Scott
et
al,
1980 ;
Mayrhofer
et
al,
1983 ;
Gorvel
et al,
1984).
Bien
que
l’induction
des
réponses
im-
munitaires
au
niveau
de
l’intestin
ait
été
démontrée
au
niveau
des
plaques
de
Peyer
(Spalding
et
al,
1984),
on
sait
que
leur
ablation
n’empêche
pas
la
réponse
immunitaire
locale
(Hamilton
et al,
1981
).
Ceci
laisse
supposer
que
cette
réponse
pourrait
s’initier
ailleurs
qu’au
niveau
des
plaques
de
Peyer,
peut-être
même
au
ni-
veau
de
l’épithélium
intestinal
où
les
cel-
lules
épithéliales
pourraient
jouer
un
rôle
dans
la
présentation
de
l’antigène
(Bland
and
Warren,
1986).
Ce
mode
d’induction
de
la
réponse
immune
serait
plus
appro-
prié
pour
un
virus
se
multipliant
dans
les
cellules
épithéliales
tel
que
le
virus
de
la
gastroentérite
transmissible
(GET)
du
porc.
Afin
de
montrer
la
possibilité
d’une
ré-
ponse
immunitaire
au
niveau
même
de
la
muqueuse,
nous
avons
identifié,
à
l’aide
du
système
streptavidine-biotine-
péroxydase
et
de
différents
anticorps
dirigés
contre
les
antigènes
de
différencia-
tion
des
leucocytes
de
porc,
les
compo-
santes
de
la
réponse
immunitaire
pré-
sentes
dans
la
muqueuse
intestinale
de
porc.
Pour
cette
étude
détaillée,
nous
avons
considéré
d’une
part
l’épithélium
et
la
lamina
propria
des
villosités
et
d’autre
part
l’épithélium
et
la
lamina
propria
des
cryptes.
MATÉRIEL
ET
MÉTHODES
Prélèvement
de
l’intestin
et
coupes
L’iléum
a
été
prélevé
immédiatement
après
l’abattage
par
exsanguination
totale
d’une
truie
Large
White
âgée
de
6
mois.
Le
contenu
a
été
éliminé
par
lavage
rapide
à
l’eau
courante
puis
remplacé
par
du
milieu
à
base
de
saccharose
(milieu
OCT,
Miles,
Elkhart).
L’ensemble
a
été
congelé
par
immersion
rapide
dans
l’azote
li-
quide
avant
d’être
transféré
dans
un
congélateur
à -80°C.
Les
coupes
de
5
pm
d’épaisseur
chacune
(cryo-microtome
TE,
SLEE,
Londres)
ont
été
sé-
chées
10
min
à
température
ambiante
avant
d’être
fixées
20
min
à
-20°C
dans de
l’acétone.
Chaque
coupe
a
été
par
la
suite
enveloppée
dans
du
papier
d’aluminium
et
conservée
à
- 80°C
avant
d’être
traitée.

Les anticorps
Tous
les
anticorps
utilisés
dans
la
Fe
étape
de
fixation
sur
les
coupes
avaient
pour
espèce
d’origine
la
souris,
soit
sous
forme
de
surna-
geant
de
culture
d’hybridomes
(anticorps
mono-
clonaux),
soit
sous
forme
d’alloantisérum
(anti-
corps
polyclonaux).
Anticorps
monoclonaux
Les
différents
anticorps
utilisés
ainsi
que
leur
spécificité
ont
été
reportés
dans
le
tableau
I.
Anticorps
polyclonaux
Il
s’agissait
d’un
allo-sérum
de
souris
anti-la
(ÇL
8701,
Cedarlane,
Hornby)
qui
reconnaît
par
ré-
action
croisée
des
antigènes
de
classe
Il
du
CMH
du
porc
(Shinohara
et
Sachs,
1982).
Anticorps
secondaires
L’anticorps
secondaire
était
représenté
par
des
IgG
biotinylées
de
mouton
anti-Ig
de
souris
(RPN
1061,
Amersham,
Amersham)
Complexe
streptavidine-biotine-péroxydase
Il
s’agissait
du
complexe
streptavidine
biotine
péroxydase
commercialisé
par
Amersham
(RPN
1051,
Amersham,
Amersham).
Mélange
révélateur
Ce
mélange
était
obtenu
après
filtration
(0,45
pm)
d’un
mélange
à
0,5
mg/ml
dans
du
tampon
phosphate
(0,15
M)
(PBS),
de
3-3’
tétrachlorhy-
drate
de
diamine
benzidine
(réf
18865,
Serva
Feinbiochemica,
Heidelberg)
et
de
0,078%
d’eau
oxygénée,
avec ou
sans
chlorure
de
co-
balt
(0,3
mg/ml,
Ega-Chemie,
Steinheim/Albuch)
(Adams,
1981).
).
Technique
de
coloration
Fixation
des
anticorps
Après
sortie
du
congélateur,
les
coupes
ont
été
réhydratées
dans
3
bains
successifs
de
PBS
sans
calcium
ni
magnésium.
Les
coupes
étaient

alors
recouvertes
par
100
wl
d’anticorps
pri-
maire
(anticorps
monoclonal
sous
forme
de
sur-
nageant
de
culture)
ou
de
milieu
de
culture
d’hy-
bridome
comme
témoin,
pendant
60
min
à
température
ambiante,
en
chambre
humide.
Après
3
lavages
de
10
min
dans du
PBS
sans
Ca
ni
Mg,
elles
étaient
recouvertes
par
100
pl
d’IgG
biotinylées
de
mouton
anti-Ig
de
souris
aux
dilutions
1/20,
1/40
ou
1/80
en
PBS-
calcium
(9
mM),
magnésium
(5
mM),
sérum
al-
bumine
bovine
(SAB)
(1 %)
durant
60
min
à
tem-
pérature
ambiante.
Les
coupes
ont
été
de
nou-
veau
lavées
3
fois
comme
ci-dessus.
Révélation
de
l’activité
péroxydasique
La
révélation
de
la
péroxydase
endogène
a
été
effectuée
en
présence
de
100
wl
de
révélateur
avec
du
chlorure
de
cobalt.
Les
coupes
ont
été
incubées
(20
min,
température
ambiante)
puis
lavées
(3
fois,
10
min,
PBS
sans
calcium
ni
magnésium).
Ensuite,
chaque
coupe
a
été
re-
couverte
avec
100
(ii
de
complexe
streptavi-
dine-biotine-péroxydase
(RPN1051,
Amersham,
Amersham)
dilué
au
1/400
en
PBS
calcium-
magnésium,
1%
SAB
puis
incubée
(30
min,
température
ambiante,
chambre
humide)
et
lavée
(3
fois,
10
min,
PBS
sans
calcium
ni
ma-
gnésium).
La
révélation
de
la
péroxydase
liée
à
la
fixa-
tion
du
complexe
a
été
effectuée
par
recouvre-
ment
de
chaque
coupe
avec
100
pl
de
révéla-
teur
sans
chlorure
de
cobalt
puis
incubation
(20
min,
température
ambiante)
et
lavage
(3
fois
2
min,
eau
du
robinet).
Intensification
de
la
coloration
Chaque
coupe
était
incubée
5
min
dans
un
bain
d’acide
osmique
(0,3
%)
puis
lavée
(6
fois,
2
min,
eau
du
robinet).
Contre
coloration
Chaque
coupe
a
été
recouverte
avec
100
wl
d’hématoxyline
de
Harris
(réactifs
RAL,
Pointet
Girard,
Villeneuve-la-Garenne)
pendant
15
s
puis
lavée
(3
min
à
l’eau
courante).
Après
incu-
bation
de
3
min
dans de
l’acide
acétique
(2%)
et
lavage
(3
min,
eau
du
robinet),
chaque
coupe
a
été
recouverte
de
carbonate
de
lithium
saturé
(3
min)
et
lavée
(3
min,
eau
du
robinet).
Déshydratation
et
montage
La
déshydratation
des
coupes
a
été
effectuée
par
trempages
successifs
dans
des
bains
d’éthanol
de
concentrations
croissantes
(un
bain
à
70°,
un
à
90°,
deux
à
100°,
3 min
chacun)
puis
dans
du
toluène
(2
bains,
3
min).
Les
coupes
ont
été
ensuite
montées
en
baume
artificiel
(Eu-
kitt,
Kindler,
Freiburg).
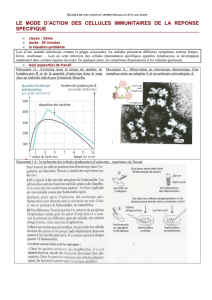
Interprétation
et
expression
des
résultats
Après
chaque
étape,
les
contrôles
de
la
colora-
tion
ont
été
effectués
à
l’oeil
nu
et
au
micro-
scope.
Après
coloration,
les
observations
ont
été
faites
au
grossissement
625,
à
l’aide
d’un
microscope
optique
(Dialux,
Leitz,
Wetzlar)
en
distinguant
2
zones :
l’épithélium
et
la
lamina
propria.
Les
cellules
colorées
ont
été
dénom-
brées
parmi
3
fois
100
cellules
épithéliales
et
parmi
3
fois
100
champs
microscopiques
de
0,004
mm
2
chacun de
la
lamina
propria.
Les
ré-
sultats
sont
exprimés
en
nombre
moyen
de
cel-
lules
pour
100
cellules
épithéliales
ou
pour
100
champs
microscopiques
(±
SEM).
Le
diamètre
moyen
de
chaque
cellule
colorée
a
été
évalué
à
l’aide
d’un
micromètre
oculaire.
L’activité
péroxydasique
endogène
se
révélait
sous
la
forme
de
granules
cytoplasmiques
colo-
rés
en
bleu-noir
par
la
diaminobenzidine
en
pré-
sence
de
chlorure
de
cobalt.
La
coloration
obte-
nue
après
marquage
avec
les
anticorps
et
fixation
du
complexe
streptavidine-biotine-
péroxydase
était
d’une
teinte
brune
uniforme
soit
membranaire
pour
les
lymphocytes
et
les
macro-
phages,
soit
cytoplasmique
pour
les
plasmocytes.
RÉSULTATS
Composantes
cellulaires
de
la
réponse
immunitaire
Non
lymphocytaires
Macrophages
Les
macrophages
dépourvus
d’activité
pé-
roxydasique
endogène
ont
été
révélés
par

la
présence
d’un
liseré
brun
cytoplasmique
avec
l’anticorps
monoclonal
74.22.15.
Dans
l’épithélium,
ces
macrophages
ne
se
retrouvaient
qu’au
niveau
des
cryptes.
Dans
le
tissu
conjonctif
des
villosités,
les
macrophages
d’un
diamètre
de
7
à
15 5
pm
étaient
7
fois
moins
fréquents
que
dans
le
tissu
conjonctif
des
cryptes
(ta-
bleau
11).
Lymphocytes
Dans
l’épithélium,
les
lymphocytes
se
dis-
tribuaient
entre
les
cellules
épithéliales
et
étaient
plus
nombreux
dans
l’épithélium
des
villosités
que
dans
celui
des
cryptes.
D’un
diamètre
de
7
à 10
0 pm,
ils
révélaient
le
phénotype
T
et
étaient
dans
l’épithélium
des
villosités,
en
majorité
constitués
par
des
lymphocytes
T
cytotoxiques
(T8).
Dans
l’épithélium
des
cryptes
des
lympho-
cytes
T4
et
T8
se
distribuaient
avec
une
fréquence
identique
(tableau
11).
Dans
le
tissu
conjonctif
de
la
lamina
propria,
on
a
observé
la
présence
de
lym-
phocytes
T
et
de
lymphocytes
de
la
lignée
B.
Les
lymphocytes
T
avaient
un
diamètre
de
6
à
10
0 pm
comme
ceux
de
l’épithélium.
Le
nombre
de
lymphocytes
auxiliaires
était
en
moyenne
supérieur
à
celui
des
lympho-
cytes
cytotoxiques
que
ce
soit
dans
les
villosités
ou
dans
les
cryptes
(tableau
11).
La
somme
des
lymphocytes
T
auxiliaires
et
suppresseurs
redonne
le
nombre
de
lymphocytes
T,
montrant
ainsi
que
tous
les
lymphocytes
T
ont
bien
été
marqués.
Les
cellules
de
la
lignée
B
présentaient
un
marquage
soit
membranaire,
soit
cyto-
plasmique.
Elles
étaient
présentes
unique-
ment
dans
la
lamina
propria,
de
préférence
sous
les
cryptes.
Les
cellules
à
immunoglobulines
mem-
branaires
(14-18
8 pm)
représentaient
55%
des
cellules
à
immunoglobulines.
Le
reste
était
constitué
par
des
cellules
à
immuno-
globulines
cytoplasmiques
d’un
diamètre
 6
6
 7
7
 8
8
 9
9
1
/
9
100%