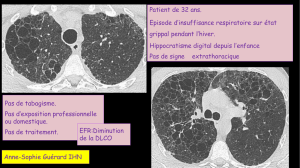
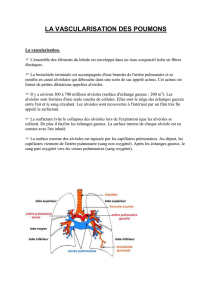
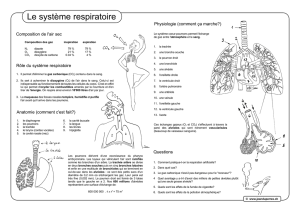
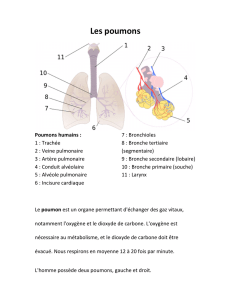
Surfactant pulmonaire : Fonction et recherche


84 © POUR LA SCIENCE - N° 295 MAI 2002
84
Comment gonfler 300 millions de petits ballons de
façon à ce qu’ils se dilatent uniformément? Les pou-
mons sont confrontés à cette difficulté à chaque ins-
piration. L’air pénètre dans la trachée, traverse les
bronches, puis emplit des ramifications de plus en plus
fines avant de déboucher sur les alvéoles pulmonaires,
de tout petits sacs élastiques où s’effectue le passage de
l’oxygène de l’air inspiré vers le sang. Pour que le trans-
fert soit efficace, il faut que la surface totale des alvéoles
soit la plus grande possible. Chez l’homme, cette sur-
face d’échange est de l’ordre de 200 mètres carrés (l’équi-
valent d’un appartement de six ou sept pièces). Quant à
l’épaisseur de la paroi de ces alvéoles, elle est 50 fois
plus mince qu’une feuille de papier, soit quelques micro-
mètres. L’oxygène de l’air diffuse à travers cette paroi vers
le sang des vaisseaux capillaires logés à l’intérieur des
cloisons séparant les alvéoles, et le dioxyde de carbone
du sang est évacué dans l’air expiré.
Comment gonfler plus de 20 000 fois par jour ces
alvéoles, d’autant que celles-ci ont tendance à s’effondrer
sur elles-mêmes, à cause de la tension superficielle qui
s’oppose à leur dilatation? Quand on ne gonfle pas suf-
fisamment une bulle de savon, elle ne s’envole pas et
reprend sa forme de membrane plane, tendue entre les
bords de l’anneau qui avait été plongé dans la solution
savonneuse. Les forces de tension superficielle sont res-
ponsables de ce mouvement de rétraction.
Dans le cas des alvéoles pulmonaires, la situation est
différente. Contrairement aux bulles de savon, les alvéoles
ne se referment jamais, et ne font que varier de diamètre
au cours du cycle respiratoire. En effet, la tension super-
ficielle sur la paroi des alvéoles est combattue par une
substance tensioactive – surfactant –, qui module les carac-
téristiques physico-chimiques de la paroi. Plusieurs
propriétés semblent jouer un rôle : cette substance dimi-
nue la tension de surface entre l’air et la paroi alvéolaire,
ce qui rend celle-ci plus extensible et facilite la dilata-
tion des alvéoles ; elle diminue les forces d’adhérence des
parois ; elle s’oppose aux forces de compression qui ten-
dent rétracter les alvéoles pendant l’expiration. Le sur-
factant pulmonaire, produit par les poumons, est
indispensable à la respiration : s’il n’est pas libéré en
quantité suffisante et au bon moment, des insuffisances
respiratoires graves surviennent. C’est pourquoi les bio-
logistes étudient les mécanismes qui contrôlent sa pro-
duction et sa libération. Quelques caractéristiques de
ces mécanismes ont été élucidées : nous examinerons com-
ment le surfactant est véhiculé jusqu’à la membrane et
quelle est sa structure lors de sa libération ; nous détaille-
rons le rôle fondamental des canaux qui prennent forme
dans la membrane et contrôlent la quantité expulsée, assu-
rant une respiration spontanée sans effort. Les diverses
études du surfactant ont pour objet la mise au point de
nouvelles molécules thérapeutiques normalisant sa sécré-
tion ; ces substances soulageraient de nombreux cas
d’insuffisance respiratoire.
Un assouplissant dans les poumons
Jusqu’au début du XXesiècle, on a considéré que les mou-
vements respiratoires résultaient de ceux de fibres élas-
tiques s’étirant lors de l’inspiration et se contractant
passivement lors de l’expiration. En effet, les muscles ins-
pirateurs entraînent une dilatation de la cage thoracique
et abaissent le diaphragme, tandis que l’expiration se
produit spontanément. Toutefois, en 1929, le concept
d’un rôle exclusif des fibres élastiques fut remis en ques-
tion par une expérience ingénieuse. Le médecin suisse
Kurt von Neergaard préleva des poumons sur des chiens
anesthésiés, et constata qu’il les gonflait plus facilement
Le surfactant
pulmonaire
PAUL DIETL •THOMAS HALLER •STEFAN SCHNEIDER
Une substance lubrifiante et tensioactive empêche les alvéoles pulmonaires
de s’effondrer sur elles-mêmes et facilite la respiration. On étudie comment
elle est libérée par les cellules pulmonaires, en espérant mettre au point
des médicaments luttant contre les insuffisances respiratoires graves.
295_dietl_fc_11_04 16/04/02 11:00 Page 84 cla Maquettistes:cla(Celine Lapert):295:pp.84_91_dietl:

85
1. ALVÉOLES pulmonaires (en vert) et bronchiole (en
brun) d’un poumon humain (grossissement : ×120).
Dennis Kunkel Microscopy, Inc.
295_dietl_fc_11_04 16/04/02 11:01 Page 85 cla Maquettistes:cla(Celine Lapert):295:pp.84_91_dietl:

86 © POUR LA SCIENCE - N° 295 MAI 2002
2. UNE VÉSICULE DE STOCKAGE lors de sa
migration dans la cellule et de sa fusion avec
la membrane du pneumocyte. Après formation
d’un pore, le surfactant est libéré sur la sur-
face externe de l’alvéole.
quand ils contenaient de l’eau plutôt
que de l’air. Or des fibres élastiques
se seraient contractées de la même
façon en présence d’air ou d’eau. D’où
venait la différence? Von Neergard ima-
gina qu’une substance tapissant les
alvéoles pulmonaires et soluble dans
l’eau s’opposait à leur extension. Il
lui attribua les propriétés d’une sub-
stance tensioactive, et supposa que le
coefficient de tension superficielle était
proche de celui du plasma sanguin. Il
en déduisit une valeur de la résis-
tance totale théorique pour le poumon,
valeur qui se trouvait être en bon accord
avec ses observations.
Ce résultat fut rapidement oublié,
jusqu’à ce qu’en 1950, E. Radford, de
l’Université Harvard, à Boston, reprenne
le flambeau en utilisant les connais-
sances accumulées pendant 20 ans sur
la structure du poumon. Reprenant les
calculs de von Neergard, il obtint cette
fois une surface alvéolaire dix fois supé-
rieure, de sorte que la tension superfi-
cielle à l’intérieur des poumons devait
être dix fois plus faible que celle du
sérum sanguin. Radford en conclut
qu’une substance tensioactive propre
au poumon réduisait de façon specta-
culaire la rigidité des alvéoles.
En 1955, Richard Pattle, à Porton
en Angleterre, mit en évidence la pré-
sence d’une substance tensioactive dans
le matériel rejeté sous forme de mousse
lors de l’œdème pulmonaire. Puis, en
1956, John Clements, du Centre Heeres
d’études chimiques du Maryland, mon-
tra que l’instillation d’extraits de pou-
mon diminuait effectivement la tension
superficielle, et empêchait les alvéoles
de se rétracter. Il étudia en outre, in vitro,
les propriétés physiques du surfactant
isolé du poumon. Le surfactant se révéla
être un mélange de protéines, de sucres,
et de deux composés lipidiques aux
extrémités hydrophiles, des substances
qui modulent la tension superficielle
(voir l’encadré page 88).
Comment ces composés «assou-
plissants» sont-ils synthétisés? On sait
aujourd’hui qu’ils sont produits par une
classe particulière de cellules des parois
des alvéoles pulmonaires, les pneu-
mocytes de type II (voir la figure 3). Les
pneumocytes de type II ne sont pas les
seules cellules des parois alvéolaires,
mais ils y jouent un rôle primordial
notamment parce qu’ils adaptent
constamment la quantité de surfactant
libéré à la surface des alvéoles, et réab-
sorbent les sels minéraux et l’eau qui
s’échappent des capillaires alvéolaires.
Les pneumocytes contrôlent
l’épaisseur du mince film d’eau,
nommé hypophase, qui tapisse la sur-
face des alvéoles : en présence d’une
quantité excessive de surfactant, les
alvéoles se distendraient, et, en cas
d’excès, s’effondreraient sur elles-
mêmes. Or l’effondrement (ou col-
lapsus) des alvéoles entraîne une
détresse respiratoire grave, les
échanges gazeux avec le sang ne pou-
vant plus s’effectuer normalement et
les muscles respiratoires s’épuisant
rapidement à tenter d’ouvrir les
espaces alvéolaires à chaque inspira-
tion. C’est ce dont souffrent notam-
ment les prématurés, chez qui le
surfactant pulmonaire est présent en
trop faible quantité, car leurs poumons
immatures n’ont pas eu le temps d’en
accumuler suffisamment. Cette patho-
logie fut diagnostiquée par Mary Ellen
Avery et par Jere Mead dès 1958 sur
des prématurés nés à l’Hôpital de Bos-
ton. Toutefois, des lésions alvéolaires
d’origines diverses, conduisant à un
déficit en surfactant, peuvent égale-
ment provoquer des détresses respi-
ratoires aiguës chez l’adulte.
La libération
du surfactant pulmonaire
Pour comprendre les mécanismes de
régulation du surfactant, on étudie les
différentes étapes de sa libération
par les pneumocytes de type II. Le sur-
factant se répand à la surface des pneu-
mocytes, traverse l’hypophase aqueuse
qui tapisse la surface, la recouvre et
forme une mince pellicule à l’interface
avec l’air. Cette phase de libération
nécessite une régulation précise : le
surfactant est stocké dans les pneu-
mocytes sous forme d’agrégats macro-
moléculaires enveloppés dans une
membrane. Dans cet état, le surfactant
ne peut traverser la membrane externe
des pneumocytes. Il doit être véhiculé
jusqu’à la membrane, puis préparé
pour la traverser. Il est empaqueté dans
de petites vésicules dont l’enveloppe
fusionne avec la membrane externe
des pneumocytes, formant alors un
pore, c’est-à-dire une ouverture vers
l’extérieur (voir la figure 2).
En observant la membrane d’un
pneumocyte au microscope, on
constate qu’au moment de traverser
ce pore, le surfactant est organisé en
couches concentriques, en «pelure d’oi-
gnon». Cet aspect caractéristique a fait
donner aux agrégats de surfactant
APPROCHE
FUSION PARTIELLE
FUSION
LIBÉRATION DU CONTENU
MEMBRANE
VÉSICULAIRE
MEMBRANE CELLULAIRE
DU PNEUMOCYTE
SURFACTANT
PULMONAIRE
PORE DE FUSION
EXTÉRIEUR
INTÉRIEUR
Illustrations : Laboratoire Paul Dietl
295_dietl_fc_11_04 16/04/02 11:01 Page 86 cla Maquettistes:cla(Celine Lapert):295:pp.84_91_dietl:

3. LES CELLULES DES ALVÉOLES PULMONAIRES synthétisent une
substance tensioactive nommée surfactant (en jaune) qui abaisse
la tension superficielle du revêtement alvéolaire (en bleu). Lorsque
le surfactant est synthétisé en quantité insuffisante, une détresse
respiratoire survient : les alvéoles pulmonaires se dégonflent, la
personne malade ou le prématuré ne peut fournir l’effort néces-
saire pour remplir les alvéoles d’air. Les échanges gazeux n’ont
plus lieu : l’oxygène de l’air n’est plus absorbé par le sang qui ne
peut plus se débarrasser du dioxyde de carbone accumulé.
FILM AQUEUX
OU HYPOPHASE
PNEUMOCYTES DE TYPE I
FORMANT LA PAROI ALVÉOLAIRE
PNEUMOCYTES DE TYPE II
LIBÉRANT LE SURFACTANT
AIR CONTENU DANS L’ALVÉOLE PULMONAIRE
ALVÉOLE PULMONAIRE
NOYAU CELLULAIRE
MOLÉCULES DU FILM
DE SURFACTANT
VAISSEAU SANGUIN
ET GLOBULES ROUGES
SURFACTANT STOCKÉ
DANS LES VÉSICULES
DIFFÉRENTES
FORMES
DU SURFACTANT
LIBÉRÉ
Laboratoire Paul Dietl/Thomas Braun
87
© POUR LA SCIENCE - N° 295 MAI 2002
295_dietl_fc_11_04 16/04/02 11:01 Page 87 cla Maquettistes:cla(Celine Lapert):295:pp.84_91_dietl:
 6
6
 7
7
 8
8
 9
9
1
/
9
100%