Vaccination prophylactique et thérapeutique contre le

TRAVAIL ORIGINAL
Vaccination prophylactique et thérapeutique
contre le papillomavirus humain
Prophylactic and therapeutic vaccination
against human papillomavirus
J.-L. Brun
a,*
, D. Riethmuller
b
a
Service de gynécologie–obstétrique, CHU Pellegrin, 33076 Bordeaux, France
b
Service de gynécologie–obstétrique, CHU Saint-Jacques, 25000 Besançon, France
Reçu le 27 octobre 2006 ; avis du comité de lecture le 14 février 2007 ; définitivement accepté le 6 juin 2007
Disponible sur internet le 05 septembre 2007
MOTS CLÉS
Papillomavirus humain ;
Vaccination ;
Cancer du col
Résumé Les papillomavirus humains (HPV) sont nécessaires au développement du cancer du
col utérin. Parmi les 120 génotypes décrits chez l’homme, une quinzaine d’HPV oncogènes à
haut risque sont impliqués dans la cancérisation. L’infection concerne environ trois femmes
sur quatre et est souvent transitoire par la mise en place d’effecteurs immunitaires aboutis-
sant à la clairance virale. Ce phénomène a permis la mise au point d’un vaccin. Les vaccins
prophylactiques sont élaborés à partir de pseudoparticules virales L1 non infectantes, bien
tolérées et très immunogènes. Elles empêchent l’infection virale par la production d’anticorps
secondairement transsudés au niveau génital (immunité humorale). Les génotypes à haut
risque retenus dans les vaccins Gardasil
®
et Cervarix
®
sont les HPV-16 et 18, responsables de
70 % des cancers. Ils préviennent l’infection à HPV et les lésions cervicales et périnéales viro-
induites dans plus de 90 % des cas. Les vaccins thérapeutiques, formés à partir de peptides
libres, de protéines ou de bactéries recombinantes, de plasmides ADN ou de cellules dendriti-
ques, sensibilisent les cellules immunocompétentes (immunité cellulaire). Inefficaces dans les
cancers du col, ils permettent une régression des dysplasies cervicales dans environ 50 % des
cas. Ils restent du domaine de la recherche, contrairement aux vaccins prophylactiques dispo-
nibles.
© 2007 Elsevier Masson SAS. Tous droits réservés.
KEYWORDS
Human papillomavirus;
Vaccination;
Cervical cancer
Abstract Human papillomavirus is a necessary cause for the development of cervical cancer.
Cervical cancer is attributed to 15 high-risk oncogenic HPV among the 120 genotypes present
in human. The infection affects about 3 out of 4 women and is often transient thanks to
immunological modulators leading to viral clearance. This characteristic made it possible to
develop vaccines. Prophylactic vaccines are made of virus-like particles L1, non infectious,
well tolerated and highly immunogenic. They prevent from viral infection by producing anti-
Journal de Gynécologie Obstétrique et Biologie de la Reproduction 36 (2007) 631–641
*
Auteur correspondant.
Adresse e-mail : [email protected] (J.-L. Brun).
0368-2315/$ - see front matter © 2007 Elsevier Masson SAS. Tous droits réservés.
doi:10.1016/j.jgyn.2007.06.005

bodies, which are secreted throughout the genital mucosa (humoral immunity). High-risk
oncogenic HPV-16 and 18, responsible for 70% of cervical cancer, are included in Gardasil
®
and
Cervarix
®
. Both vaccines prevent from HPV infection and related cervical and perineal lesions
in more than 90% of the cases. Therapeutic vaccines are made of epitope peptides, recombi-
nant proteins and bacteria, plasmid DNA or dendritic cells. All sensitize immunocompetent
cells (cellular immunity). Ineffective in cervical cancers, they induce the regression of cervi-
cal dysplasia in about 50% of the cases. They are still under research and development, in
opposition to prophylactic vaccines, which are available.
© 2007 Elsevier Masson SAS. Tous droits réservés.
De nombreuses approches vaccinales ont récemment été
développées pour lutter contre les infections génitales à
papillomavirus humain (HPV), dont certaines sont impli-
quées dans la carcinogenèse du col utérin. L’objectif de
cette revue est de reporter les différents essais cliniques
publiés à ce jour ayant conduit au développement des vac-
cins prophylactiques et thérapeutiques et de discuter la
place qu’ils pourraient avoir dans l’avenir.
Cancer du col de l’utérus
Le cancer du col de l’utérus, second cancer de la femme
dans le monde, est responsable d’environ 250 000 décès
par an au niveau mondial [1].
En France, le cancer du col est au huitième rang des can-
cers de la femme, mais reste le deuxième cancer de la
femme jeune. En 2000, 3400 nouveaux cas étaient déclarés
et environ 1000 décès annuels sont rapportés à ce cancer
[2].
Le cancer du col est quasi inexistant avant 20 ans et
atteint son incidence maximale de 20 pour 100 000 chez
les femmes de 40 ans. L’incidence se stabilise ensuite
autour de 17 pour 100 000 jusqu’aux âges les plus avancés
[2].
Le dépistage des anomalies cytologiques par le frottis
cervical a permis, au cours des 20 dernières années, une
réduction de l’incidence de ce cancer de près de 3 % par
an [2].
Les HPV dits à « haut risque » sont rencontrés dans plus
de 99 % des cancers du col utérin [3]. Ce cancer est la pre-
mière démonstration dans l’espèce humaine du caractère
viro-induit obligatoire d’une tumeur solide. Les deux géno-
types les plus fréquemment rencontrés sont les HPV-16 et
18, associés respectivement à environ 50 et 20 % des can-
cers du col [3–5]. Des cofacteurs existent, tels que les défi-
cits immunitaires, le tabagisme, la contraception orale, la
multiparité, etc. [6,7]. Mais l’agent nécessaire, bien que
non suffisant, est l’HPV à haut risque.
Infections à HPV
Les HPV appartiennent à la famille des papillomaviridae.
Ces petits virus sont constitués d’une capside icosaédrique
de 45 à 55 nm de diamètre formée de 72 capsomères. Le
génome viral d’environ 8000 paires de bases se présente
sous la forme d’ADN circulaire bicaténaire, dont seul un
brin est codant et comporte trois régions : la région précoce
E(early) codant des protéines non structurales (E1 à E7)
dont les oncoprotéines, la région tardive L (late) codant
des protéines structurales dont les protéines de capside
(L1 et L2) et enfin une région non codante de régulation
URR (upstream regulation region)(Fig. 1).
Les HPV possèdent une spécificité d’hôte très étroite.
Plus de 120 génotypes ont été retrouvés chez l’être
humain. Ils sont répartis en différents types phylogéniques
en fonction de leur pourcentage de concordance nucléoti-
dique et de leur tropisme cutané ou muqueux (génital,
anal, oral). Quarante ont un tropisme génital et 15 sont
oncogènes (à haut risque), responsables des dysplasies et
cancers du col utérin, de l’anus et de la vulve. Ces 15
virus, détectables par les techniques de biologie molécu-
laire (Capture d’hybrides, PCR), sont classiquement répartis
en type α9 (16,31,33,35,52,58), α7 (18,39,45,59) ou non
α7-α9 (51,56,66,68,73).
Figure 1 Structure du génome viral de l’HPV et rôle des pro-
téines virales. E1 : réplication ; E2 : réplication et régulation
de la transcription ; E4 : maturation et relargage des virions ;
E5 : prolifération cellulaire ; E6 : dégradation de p53 (Immorta-
lisation et transformation de la cellule hôte) ; E7 : dégradation
de pRb (Immortalisation et transformation de la cellule hôte) ;
L1 : protéine majeure de capside ; L2 : protéine mineure de
capside ; URR : région de régulation non codante.
Figure 1 Structure of HPV genome and role of viral proteins.
J.-L. Brun, D. Riethmuller632

Les infections à HPV sont les infections sexuellement
transmissibles les plus fréquentes, car leur contagiosité
est élevée. Dans la population finlandaise, le risque pour
une femme de contracter un HPV au cours de sa vie sexuelle
est de 79 % [8]. Dans un groupe de jeunes étudiantes amé-
ricaines, 60 % ont eu au moins un épisode d’infection à HPV
avant ou pendant un suivi de trois ans [9].
Ces infections sont le plus souvent asymptomatiques et
transitoires. Dans une minorité de cas, le portage viral per-
siste au-delà d’une année qui est le délai moyen de la clai-
rance virale. Cela favorise l’intégration virale au sein des
cellules épithéliales, à l’origine d’une possible transforma-
tion tumorale. En effet, toutes ces anomalies du tissu épi-
thélial ne progressent pas. L’évolution potentielle vers le
cancer demande de nombreuses années et passe par diffé-
rents stades d’anomalies histologiques intraépithéliales
préinvasives. Seules les lésions intraépithéliales de haut
grade ou néoplasies intracervicales (CIN) 2 et 3 sont à
risque de cancer invasif [10].
Les HPV dits « à bas risque » sont responsables de patho-
logies génitales non malignes et non dégénératives. Les
génotypes 6 et 11 sont à l’origine de 90 % des condylomes
acuminées anogénitaux [11]. Ils sont aussi impliqués dans la
papillomatose orale et laryngée. En France, 300 000 à
600 000 individus sont atteints de condylomes acuminés et
le nombre annuel d’épisodes traités varie entre 180 000 et
200 000 [12]. Ces lésions affectent surtout les gens jeunes
et leur diagnostic clinique est le plus souvent aisé. Le trai-
tement est, en revanche difficile avec un taux de récidives
élevé. Le retentissement psychologique est important et il
n’existe pas de moyen de prévention efficace comme par
exemple, le préservatif [13].
Par leur fréquence et le risque de lésions précancéreu-
ses, voire de cancer du col qu’elles induisent, les infections
à HPV représentent un important problème de santé
publique.
Approches vaccinales
Pour lutter contre l’infection HPV et/ou ses conséquences,
deux approches vaccinales différentes ont été
développées : la vaccination prophylactique cherche à évi-
ter l’infection virale en protégeant l’individu par la produc-
tion d’anticorps (immunité humorale), alors que la vaccina-
tion thérapeutique a pour objectif d’entraîner la guérison
des lésions histologiques viro-induites par sensibilisation
de cellules immunocompétentes (immunité cellulaire). Le
développement avancé de la vaccination prophylactique
permet une mise à disposition en 2007, alors que la vacci-
nation thérapeutique en est encore aux stades d’essais cli-
niques.
Vaccination prophylactique
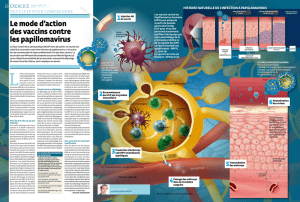
Les vaccins prophylactiques ont pour objectif d’induire la
production d’anticorps neutralisants dirigés contre la cap-
side virale. Ces anticorps doivent être présents au niveau
de la muqueuse et des sécrétions cervicovaginales avant la
première exposition au virus. Les vaccins antiviraux sont
classiquement basés sur une atténuation ou une inactiva-
tion virale, voire des antigènes purifiés. Cette stratégie
n’est pas applicable pour l’HPV, car ce dernier n’est pas
cultivable et le génome viral contient des oncogènes (E6
et E7). L’approche choisie a été de cibler les protéines de
la capside virale. Cette démarche n’a été rendue possible
que grâce à la découverte de la propriété d’autoassemblage
en grande quantité de la protéine majeure de capside L1
dans différents systèmes eucaryotes [14]. Cela permet la
formation de pseudoparticules virales VLP (virus-like-parti-
cles). Les VLP ne contiennent pas de génome viral, ont la
même morphologie que celle des virions, sans caractère
pathogène, et sont capables d’induire la production de
titres élevés d’anticorps neutralisants dirigés contre la pro-
téine L1 [15]. Les VLP sont produites par l’insertion du gène
L1 (gène indemne de séquence oncogène) dans des cellules
d’insectes (infectées par des baculovirus) ou dans des levu-
res (saccharomyces cerevisiae). L’adjonction de la protéine
mineure de capside L2 augmente la quantité de VLP assem-
blées, mais pas le caractère immunogène de la particule
[16].
Ces vaccins VLP concernent un ou plusieurs types d’HPV
et leur efficacité a été évaluée dans des essais rapportés
dans le Tableau 1.
Vaccin monovalent HPV-16
Les vaccins, basés sur la technologie des VLP L1, ont montré
dès 2001 des résultats encourageants sur la protection des
infections HPV et des lésions cytohistologiques induites
[17]. Mais, le véritable espoir vaccinal a vu le jour en 2002
après la publication d’une étude randomisée en double insu
sur un vaccin monovalent HPV-16 [18]. Elle concerne 2392
femmes de 16 à 23 ans ayant reçu, par voie intramuscu-
laire, trois doses de vaccin VLP L1 HPV-16 ou un placebo.
Le schéma d’administration était zéro, deux et six mois.
Les effets indésirables étaient identiques dans les groupes
vaccinés et placebo. Le suivi moyen était de 17,4 mois.
Aucune infection, ni dysplasie n’était observée dans le
groupe vaccin, alors qu’une infection persistante à HPV-16
survenait chaque année chez 3,8 % des femmes du groupe
placebo (dont neuf cas de CIN). Ce travail a jeté les bases
de la vaccination monovalente contre HPV-16, efficace à
100 % et bien tolérée.
Le suivi à plus long terme de cette cohorte a permis de
confirmer l’efficacité de VLP L1 HPV-16, puisque la fré-
quence des infections à HPV-16 était significativement
réduite chez les femmes vaccinées par rapport au groupe
placebo [19]. En effet, 40 mois après la réalisation du pro-
gramme complet de vaccination, 111 cas d’infections à
HPV-16 et 12 CIN 2/3 ont été détectés dans le groupe pla-
cebo (n= 750), contre sept et zéro cas respectivement dans
le groupe vaccination (p< 0,01). L’efficacité vaccinale était
donc de 94 %, IC 95 % : 88–98 % sur la prévention des infec-
tions persistantes à HPV-16 et de 100 %, IC 95 % : 65–100 %
sur la prévention des lésions intraépithéliales de haut
grade. En termes d’immunogénicité, le titre moyen des
anticorps anti-HPV-16 était bas (< 5 mMU/ml) et stable
dans le groupe placebo, alors qu’il était significativement
augmenté dans le groupe vacciné avec un pic à la fin du
programme vaccinal au septième mois (> 1000 mMU/ml),
puis une phase en plateau (> 100 mMU/ml) stable sur
48 mois.
Vaccination prophylactique et thérapeutique contre le papillomavirus humain 633

Les travaux actuels n’ont pas encore mis en évidence un
épitope conformationnel immunogène commun à la quin-
zaine de génotypes à haut risque impliqués dans la carcino-
genèse. L’objectif vaccinal est de permettre la meilleure
prévention de l’infection par les génotypes les plus fré-
quemment retrouvés dans les cancers du col de l’utérus.
Or, il n’est pas possible à ce jour de mettre plus de quatre
valences différentes dans un vaccin du fait de la complexité
de mise en œuvre et des contrôles drastiques de qualité. La
protection sera donc forcément incomplète et cela ne
remet pas en cause le dépistage. Toutefois, du fait de la
répartition génotypique, la protection contre les HPV de
génotype 16 et 18 devrait amener une diminution d’au
moins 70 % du risque de cancer cervical [5] (Fig. 2).
Deux vaccins utilisant la technologie des VLP L1 sont
actuellement parvenus à un stade de développement
clinique avancé (phase III) dont les derniers résultats sont
très concluants : un vaccin bivalent Cervarix
®
(GlaxoSmith-
Kline, Rixensart, Belgique ; MedImmune, Gaithersburg,
Maryland) dirigé contre les HPV-16 et 18 ; un vaccin quadri-
valent Gardasil
®
(Merck/Sanofi Pasteur MSD, West Point,
Pennsylvanie) dirigé contre les HPV-16 et 18, ainsi que les
HPV à bas risque 6 et 11.
Vaccin bivalent HPV-16 et 18
Dans une étude randomisée en double insu, 1113 femmes
de 15 à 25 ans ont reçu trois doses de vaccin VLP L1 HPV-
16 et 18 Cervarix
®
ou un placebo [20]. Le schéma d’admi-
nistration était zéro, un et six mois. Les effets indésirables
n’étaient pas différents dans les deux groupes. Une évalua-
Tableau 1 Caractéristiques et résultats des essais randomisés de vaccination prophylactique
Table 1 Characteristics and results of randomized trials on prophylactic vaccination
Étude Koutsky [18] Mao [19] Harper [20] Harper [21] Villa [22]
Types de VLP L1 HPV 16 16 16, 18 16, 18 6, 11, 16, 18
Adjuvant Aluminium Aluminium ASO4 ASO4 Aluminium
Laboratoire MSD MSD GSK GSK MSD
Sites d'étude USA USA USA, CA, BR USA, CA, BR USA, EU, BR
Âge des patientes (ans) 16–23 16–23 15–25 15–25 16–23
Calendrier vaccinal (mois) 0–2–60–2–60–1–60–1–60–2–6
Patientes randomisées (n) 2392 2391 1113 776 552
Protocole respecté (n) 1533 1505 721 694 468
Durée du suivi (ans) 1,5 3,5 1,5 4,5 2,5
Infections persistantes
Vaccin/placebo (n) 0/41 7/111 0/7 0/7 4/36
Efficacité [% (IC 95 %)] 100 (90–100) 94 (88–98) 100 (47–100) 100 (34–100) 90 (71–97)
Lésions intraépithéliales
Vaccin/placebo (n) 0/9 0/12 2/27 0/8 0/3
Efficacité [% (IC 95 %)] 100 (90–100) 100 (65–100) 93 (70–98) 100 (42–100) 100 (16–100)
VLP-HPV : particules pseudovirales du papillomavirus ; MSD : Merck/Sanofi Pasteur ; GSK : GlaxoSmithKline ; USA : États-Unis ; CA : Canada ; BR :
Brésil ; EU : Europe ; IC 95 % : intervalle de confiance à 95 %.
Figure 2 Répartition (%) des cancers du col attribués aux génotypes HPV les plus fréquents [5].
Figure 2 Percentages of cervical cancer cases attributed to the most frequent HPV genotypes [5].
J.-L. Brun, D. Riethmuller634

tion était faite à 18 et 27 mois. L’efficacité vaccinale était
de 100 %, IC 95 % : 47–100 % sur la prévention des infections
persistantes à HPV-16 et 18 lorsque le protocole était res-
pecté (p= 0,007) et de 95 %, IC 95 % : 64–99 % en intention
de traiter (p< 0,001). L’efficacité était de 93 %, IC 95 % :
70–98 % sur les anomalies cytologiques induites par les
HPV-16 et 18 (p< 0,001).
Le suivi de cette cohorte jusqu’à 4,5 ans confirme
l’excellente protection vis-à-vis des infections à HPV-16 et
18 et la bonne tolérance du vaccin [21]. Elle rend aussi
plausible l’hypothèse d’une réaction protectrice croisée
entre les différents génotypes oncogéniques. Plus de 98 %
des femmes ont développé des anticorps anti-HPV-16 et 18
dès le septième mois, avec un maintien de cette immunité
humorale au-delà de quatre ans. L’efficacité vaccinale était
de 94 %, IC 95 % : 63–100 % sur la prévention des infections à
HPV-16 et 18 persistant pendant six mois (p< 0,001) et de
100 %, IC 95 % : 34–100 % sur celles persistant pendant
12 mois (p= 0,006). L’efficacité était de 100 %, IC 95 % :
42–100 % sur les anomalies cytologiques supérieures à CIN
1 induites par HPV-16 et 18 (p= 0,003) et de 59 %, IC
95 % : 1–84 % pour les lésions induites par les 15 types
d’HPV à haut risque détectés par capture d’hybrides
(p= 0,032). En effet, l’HPV-45, phylogénétiquement proche
de l’HPV-18, semble être aussi couvert par ce vaccin biva-
lent avec une efficacité de 94 %, IC 95 % : 63–100 %. L’infec-
tion par HPV-31, phylogénétiquement proche de l’HPV-16,
est diminuée de 55 %, IC 95 % : 12–78 %. Les HPV-31 et 45
étant responsables à l’échelle mondiale de près de 10 %
des cancers du col de l’utérus, le taux de réduction de can-
cer par la vaccination serait plus proche des 80 % que des
70 % espérés initialement, si ces réactions de protections
croisées se confirmaient.
Vaccin quadrivalent HPV-6, 11, 16, 18
L’efficacité et la tolérance du vaccin quadrivalent ont été
démontrées dans une étude de phase II randomisée en
double insu incluant 552 femmes âgées de 16 à 23 ans [22].
Elles ont reçu trois doses de vaccin VLP L1 HPV-6, 11, 16,
18 Gardasil
®
ou un placebo par voie intramusculaire. Le
schéma d’administration était zéro, deux et six mois. Les
effets indésirables n’étaient pas différents dans les deux
groupes. Une évaluation était faite à 36 mois. Lorsque le
protocole était respecté, l’efficacité vaccinale était de
90 %, IC 95 % : 71–97 % sur la prévention des infections per-
sistantes à HPV-6, 11, 16, 18 et de leurs conséquences
(p< 0,001). Elle était respectivement de 89 %, IC 95 % :
70–97 % pour les infections persistantes (p< 0,001) et de
100 %, IC 95 % : 16–100 % pour les lésions cliniques
(p= 0,015), qu’ils s’agissent des CIN ou des verrues génita-
les. L’efficacité dépendait peu du type viral : elle était de
100 % pour les HPV-6 et 11, de 86 % pour l’HPV-16 et de 89 %
pour l’HPV-18.
En termes d’immunogénicité, les taux des anticorps anti-
HPV-6, 11, 16 et 18 au bout de deux mois étaient 12 à 26
fois plus élevés qu’avant vaccination, puis diminuaient sen-
siblement pour atteindre une phase en plateau (de l’ordre
de 100 mMU/ml) stable sur 36 mois [23]. En revanche, le
titre moyen des anticorps anti-HPV restait bas
(< 5 mMU/ml) dans le groupe placebo. Par ailleurs, les titres
obtenus après vaccination étaient significativement plus
élevés chez les adolescentes que chez les femmes adultes,
ce qui laisse présager une prévention efficace dès le plus
jeune âge.
Particularités des différents vaccins
Le vaccin quadrivalent permet une excellente protection
contre les condylomes acuminés puisque les génotypes 6
et 11 inclus dans le vaccin sont responsables de 90 % des
verrues génitales [11]. Les condylomes acuminés ne repré-
sentent pas une pathologie grave au sens vital, mais restent
un véritable problème de santé publique par ses implica-
tions psychologiques non négligeables, ses traitements sou-
vent multiples et ses récidives fréquentes. Par ailleurs, cer-
taines lésions intraépithéliales de bas grade sont induites
par ces génotypes à bas risque. Ainsi, ce vaccin pourrait
diminuer plus largement le nombre de frottis de bas grade
lors du dépistage postvaccinal. Enfin, la promotion du vac-
cin HPV implique une information des parents sur la préven-
tion des infections sexuellement transmises, en plus de
celle sur la prévention du cancer du col.
Le vaccin bivalent utilise un adjuvant original le ASO
4
qui
aurait la particularité de stabiliser les pseudoparticules
virales au cours du stockage et d’induire un pic de titre
d’anticorps avec de plus faibles doses d’antigènes, ce qui
a déjà été démontré avec le vaccin hépatite B [24]. Enfin,
le taux intéressant de protection croisée serait lié à l’adju-
vant [21]. Il faudra, toutefois, attendre le résultat des lar-
ges études en cours avec le vaccin quadrivalent qui utilise
comme adjuvant un classique sel d’aluminium, avant de
conclure à l’avantage du vaccin bivalent en termes de réac-
tions croisées.
Vaccination thérapeutique
Le but de la vaccination thérapeutique est de sensibiliser
les cellules immunocompétentes pour neutraliser l’infec-
tion HPV déjà installée et faire régresser les lésions précan-
céreuses, voire les cancers du col utérin.
Les vaccins thérapeutiques peuvent être formés à partir
de peptides libres, de protéines recombinantes, de virus ou
de bactéries recombinants associés à des gènes codant pour
certains types d’HPV, à partir de fragments de plasmide
ADN ou de cellules dendritiques sensibilisées par des anti-
gènes viraux. Tous stimulent l’immunité T cellulaire en pré-
sentant les antigènes vaccinaux à la surface des cellules qui
les ont intégrés en association avec les molécules HLA de
classe I ou II afin de stimuler respectivement les lymphocy-
tes T CD8+ et CD4+.
Les principales études évaluant l’efficacité vaccinale
chez les femmes ayant une lésion intraépithéliale de haut
grade sont rapportées dans le Tableau 2.
Vaccins peptidiques
Les vaccins peptidiques ont été testés chez des femmes
ayant une lésion cervicale intraépithéliale de haut grade
ou un cancer invasif dans des études de phase I-II [25,26].
Ces peptides codés par le gène E7 de l’HPV-16 sont immu-
Vaccination prophylactique et thérapeutique contre le papillomavirus humain 635
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%