CHAINE RESPIRATOIRE ET OXYDATIONS PHOSPHORYLANTES

FACULTE
DE MEDECINE DE CONSTANTINE
LABORATOIRE DE
BIOCHIMIE
CHAINE
RESPIRATOIRE
ET
OXYDATIONS
PHOSPHORYLANTES
PAR DR N. KOUIDER

PLAN
1/ INTRODUCTION
11/
VUE GENERALE SUR LA CHAINE RESPIRATOIRE MITOCHONDRIALE
1/ ORIGINE DES H2 ET 02 NECESSAIRES A LA CHAINE
2/
LOCALISATION DES COENZYMES REDUITS
3/
ELEMENTS DE LA CHAINE D'OXYDOREDUCTION MITOCHONDRIALE
111/
LES QUATRE COMPLEXES TRANSPORTEURS DE GREEN
IV/
BILAN
ENERGETIQUE DE LA CRM
V/ COMPLEXE V : ATP SYNTHASE
VI/ COUPLAGE ENTRE CHAINE DE TRANSPORT DES ELECTRONS ET ATP
SYNTHASE : théorie chimiosmotique
VII/REGULATION DE LA CRM
VIII/
AGENTS DECOUPLANTS ET
INHIBITEURS
DE LA CRM

CHAINE
RESPIRATOIRE
ET
OXYDATIONS
PHOSPHORYLANTES
/
1/
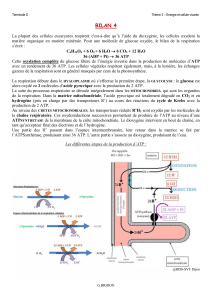
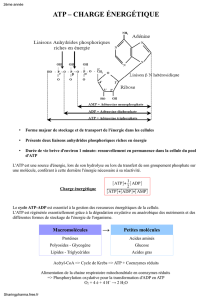
Introduction :
La
quantité
d'ATP
dont un
être
humain a besoin pour vivre est impressionnante. Un homme
sédentaire
de 70 !<g
requiert
environ 2000
kcal
pour un jour
d'activité.
Pour
fournir autant
d'énergie,
il faut 83 kg
d'ATP.
Cependant,
un
être
humain ne contient qu'environ 250 g
d'ATP.
La
disparité
entre la
quantité
d'ATP
que nous
possédons
et la
quantité
que nous
dépensons
est
expliquée
par le
recyclage
de
l'ADP
en ATP.
Chaque
molécule
d'ATP
est
recyclée
environ 300 fois par jour. Ce
recyclage
est
effectué
principalement par la phosphorylation oxydative.
L'énergie
emmagasinée
dans
les lipides, les
glucides
et les
protéines
doit
être
convertie en une forme
immédiatement
utilisable. Les
réactions
d'oxydation du catabolisme (glycolyse,
(3
oxydation des
acides
gras,
catabolisme des
acides
aminés,
cycle
de
l'acide
citrique)
enlèvent
aux substrats des atomes
d'hydrogène
(protons
+
électrons)
qui sont pris en
charge
par les
coenzymes
NAD et FAD.
-
D'une
part, la
réoxydation
de ces
coenzymes
est indispensable à l'entretien du catabolisme oxydatif.
D'autre part, le pouvoir
réducteur
des ces
coenzymes
est
utilisé
à la
synthèse
d'ATP.
Le
processus
qui couple la
réoxydation
des
NADH,
H+ et
FADH2
à la
synthèse
d'ATP
par phosphorylation de
l'ADP
est
appelé
oxydations phosphoryiantes
NB : On peut dire
aussi
phosphorylations oxydatives, mais cette appellation reste impropre car ce sont les
oxydations qui
précèdent
la phosphorylation.
11/
vue
générale
sur la
chaîne
respiratoire mitochondriale :
Dans
la
chaîne
respiratoire, les
électrons
provenant de
différentes réactions
intracellulaires sont pris en charge. Ils
parcourent une suite d'étapes redox en direction de l'oxygène pour
réduire
ce dernier finalement en eau.
C'est
par
étape
que l'énergie libre
nécessaire
à la
synthèse
d'ATP
est fournie par l'oxydation des
NADH,
H+ et des
FADH2.
Les
équivalents réducteurs
sont
transférés
de couple redox en couple redox
dans
le
sens
du gradient de
potentiel
redox du plus
négatif
vers
le plus positif,
jusqu'à
l'oxygène
moléculaire.
Ces couples redox
transfèrent
soit un ion hydrure(NAD), soit deux atomes
d'hydrogène
(FAD, coenzyme Q), soit un
électron
(cytochromes).
L'ensemble
de ces
coenzymes
d'oxydoréduction
et des
enzymes
dont ils sont le groupement
prosthétique
constitue la
chaîne
respiratoire.
Au cours de leur
trajet,
les
électrons
abandonnent leur
énergie
pour constituer un gradient de protons à travers
la membrane interne de la mitochondrie. Ce gradient permet la production
d'ATP
à partir
d'ADP
et de phosphate
inorganique,
1

ATP
A
02
La chaine respiratoire est localisée
dans
la membrane interne des mitochondries où se trouvent les transporteurs
d'é.
Elle
produit de
l'ATP
et de
l'eau
selon
un
processus
couplé constitué de deux
sous-ensembles
distincts qui ont une
fonction
propre :
-
La chaine
d'oxydoréduction
produit
l'HZO
par transport
vers
r02 des
hydrogènes
(H+ et é) des
coenzymes
réduits
;
c'est
la respiration cellulaire
-
La phosphorylation de
l'ADP
en ATP est réalisée grâce à l'énergie produite graduellement par la chaine
d'oxydoréduction
L'association
des ces deux types de réaction
c'est
l'oxydation phosphorylante.
1/
Origine des H2 et 02
nécessaires
à la chaine :
•
H2 provient des
coenzymes
réduits :
NADH,
H+ et
FADH2.
Ces deux
coenzymes
réduits sont les substrats
de la chaine respiratoire mitochondriale
•
02
moléculaire
est apporté aux
tissus
par la respiration, la circulation
sanguine
et la diffusion
dans
les
tissus.
2/ Localisation des
coenzymes
réduits ;
•
FADH2
: mitochondries
•
NADH,
H-i- : - mitochondries : entre directement
dans
la chaine
-
cytosol :
nécessité
de « navettes » pour rentrer
dans
les mitochondries car les nucléotides
ne traversent pas la membrane mitochondriale.
3/
Eléments
de la chaine
d'oxydoréduction
mitochondriale :
La phosphorylation oxydative comprend deux parties ; durant la première
phase,
des électrons (é) sont t transmis
du
NADH
et du
FADH2
à de r02 ; ce transport
d'électrons
est couplé à la translocation de protons (H+) de la
matrice
vers
l'espace
intermembranaire. Durant la deuxième
phase,
l'énergie
emmagasinée
de façon
H+ H+ H-H
Electrons
Chaine
respiratoire
2

intermédiaire,
sous forme d'un gradient de protons à travers la membrane mitochondriale interne, est
mobilisée
par un courant inverse de H+
vers
la matrice pour permettre la
synthèse
d'ATP.
La'chaine
respiratoire
localisée
dans la membrane mitochondriale interne est
constituée
:
- de quatre transporteurs d'é
appelés
complexes de
GREEN
(I,
11,
111,
IV) qui sont
fixes,
formés
de
protéines
enchâssées
dans la membrane interne (le complexe II
étant
sur la
face
matricielle) et
liés
à des groupements
prosthétiques
d'oxydoréduction
; FAD, FMN,
protéines
à centre
Fer-Soufre
et cytochromes.
/deux transporteurs mobiles
d'électrons
(ubiquinone et cytochrome C) qui assurent la
continuité
de la chaine en
reliant
les
éléments
fixes.
Le transport d'é du complexe I au complexe IV est
séquentiel
:
i-UQ - lll-cyt-IV
Ou ll~UQ - lll-cyt-IV
111/
Les
quatre
complexes
transporteurs
de
GREEN
:
1/
Complexe
I :
NADH
- Coenzyme Q
oxydoréductase
-
Catalyse
le transfert de
l'hydrogène
du NADH,H+
vers
l'ubiquinone
Contient la FMN et plusieurs
protéines
à centre
Fer-Soufre
Il
reçoit
les
équivalents réducteurs
du NADH, H+ ;
-D'origine mitochondriale : p oxydation des
acides
gras, transformation du pyruvate en
acétyl-CoA
et
cycle
de
l'acide
citrique.
-D'origine cytosolique : glycolyse
-
L'entrée
du NADH, H+ dans la chaine se
fait
au niveau du complexe I
- Le substrat du complexe I est le NADH,
H-i-(E°
=
-
0,32 V) et l'accepteur de H+ et é est le Coenzyme Q
(ubiquinone) (E"
=
0,06 V)
- l'objectif du complexe I est de
réoxyder
le NADH, H-i- en NAD+ et de
transférer
2H-i-
2é sur le Coenzyme Q à
travers le FMN et les
protéines
à centre
Fer-Soufre.
NADH, H+ + UQ (Ubiquinone) • NAD+
UQH2
(ubiquinol)
- L'ubiquinol
formé
est
très
mobile dans la membrane et migre
vers
le complexe III
- Le complexe I est un site de pompage des H+ : en effet cette
réaction
d'oxydoréduction
est exergonique et
libère
suffisamment
d'énergie
dont une partie est
utilisée
par l'enzyme pour
déplacer
des protons depuis la
matrice
vers
l'espace
intermembranaire ;
c'est
un saut
d'énergie
suffisant.
2/Complexe
II : ou succinate-Coenzyme Q
oxydoréductase
assemble :
- la
succinate-déshydrogénase,
à coenzyme FAD, enzyme qui
catalyse
la
6^""^
réaction
du
cycle
de
l'acide
citrique.
3
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%