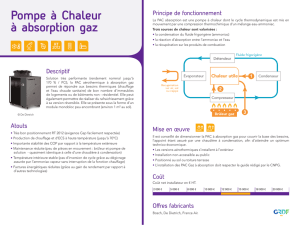
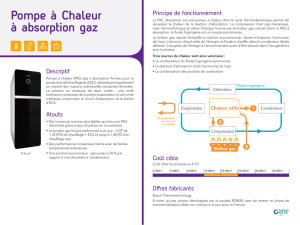
L. EL GAINI
Chapitre 1: Introduction à la spectroscopie
Chapitre 2: Spectrométrie d’absorption de l’ultraviolet et du visible (UV-Visible)
Chapitre 3: Spectrométrie de fluorescence (Fluorimétrie ou spectrofluorimétrie)
Chapitre 4: Spectrométrie infrarouge (IR)

1- Principes de Base et Théorie
Spectrométrie d’absorption de l’ultraviolet et du visible (UV-Visible)
Le domaine spectral UV-VIS

1- Principes de Base et Théorie
Spectrométrie d’absorption de l’ultraviolet et du visible (UV-Visible)
L’origine des absorptions
L’énergie absorbée dans la région UV-Visible produit des variations dans l’énergie électronique de la
molécule résultant de transitions d’électrons de valence dans celle-ci.
Ces transitions consistent en l’excitation d’un électron d’une orbitale moléculaire occupée (habituellement
une orbitale n non liante ou πliante) vers l’orbitale d’énergie supérieure (une orbitale anti-liante, π*ou *).
E = h
Transitions
*
*
n *
n *niveaux liants occupés
niveaux antiliants vacants
*
*
n
niveau non liant occupé

1- Principes de Base et Théorie
Spectrométrie d’absorption de l’ultraviolet et du visible (UV-Visible)
Transitions électroniques des composés organiques
La longueur d'onde d'absorption dépend de la nature des orbitales mises en jeu :
*
*
n
E = h
Transition *
La grande stabilité des liaisons σdes composés organiques fait que la transition d'un
électron d'une OM liante σvers une OM antiliante σ* demande beaucoup d'énergie. La
bande d’absorption correspondante est intense (transition permise)et située dans l’UV-
lointain, vers 130 nm.
Les hydrocarbures saturés sont transparents dans la région de l’UV proche solvants
Hexane max =135 nm =10000
Transition *
La transition électronique dans les composés possédant une double liaison isolée
conduit à une forte bande d'absorption (transition permise) vers 165-200 nm.

1- Principes de Base et Théorie
Spectrométrie d’absorption de l’ultraviolet et du visible (UV-Visible)
Transitions électroniques des composés organiques
Les électrons n (des atomes O, N, S, Cl..)ne forment pas de liaison, ils ne leur correspond pas d’orbitale
antiliante, ils peuvent subir deux types de transitions.
*
*
n
E = h
Transition n *
Le transfert d'un électron du doublet n d’un hétéroatome (O, N, S, Cl..) à un niveau σ* est
observé pour les alcools, les éthers, les amines ainsi que pour les dérivés halogénés.
Cette transition donne une bande d'intensité moyenne (transition interdite)qui se situe à
l'extrême limite du proche-UV.
Transition n *
Cette transition résulte du passage d'un électron d'une OM non-liante n à une OM
antiliante *. Ce type de transition a lieu dans le cas des molécules comportant un
hétéroatome porteur de doublets électroniques libres appartenant à un système insaturé.
La plus connue est celle qui correspond à la bande carbonyle située entre 270 et 280
nm.Le coefficient d'absorption molaire est faible (transition interdite).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
1
/
31
100%