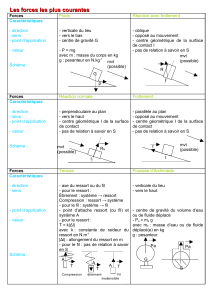
Examen de Chimie-Physique : Acides, Alcènes, Réactions Nucléaires
Telechargé par
Micaël Penkalomian BICABA

SUJET 11
Chimie
Exercice 1
1) Une solution S d’acide méthanoïque a été préparée par dissolution de 230mg d’acide pur dans
un demi litre d’eau distillée. Le coefficient d’ionisation de l’acide méthanoïque dans la solution S
vaut
13,0
.
a) Calculer les concentrations de toutes les espèces chimiques présentes dans la solution S.
b) Calculer le pH de cette solution sachant que le pKa du couple considéré est 3,8.
2) On mélange 12ml de solution S et 48ml d’eau pour obtenir une solution S’dans laquelle
[HCOOH] = 1,4.10-3 mol/L.
a) Calculer le pH de la solution S’.
b) Calculer le coefficient d’ionisation
'
’de l’acide méthanoïque dans la solution S’
c) Comparer
et
’ puis conclure
3) On dose maintenant 10ml de la solution S contenant quelques gouttes d’un indicateur coloré
approprié, par une solution d’hydroxyde de sodium de concentration inconnue. La solution
change de couleur après qu’on ait versé 50ml de soude dans la solution S.
a) Que signifie le changement de coloration de la solution ?
b) Ecrire l’équation bilan de ce dosage
c) Calculer la concentration de la solution de soude
d) Calculer la masse d’hydroxyde de sodium à dissoudre sans variation de volume dans 10ml de
la solution S pour que son pH soit égal à 3,8.
Données : C :12 ; H :1 ; O :16.
Exercice 2
L'hydratation d’un alcène A conduit à un seul composé B. Le composé B réagit avec le
permanganate de potassium en milieu acide pour donner un compose C qui donne un test positif
avec la 2,4 - DNPH mais est sans action avec le réactif de Tollens.
1) a) Indiquer la fonction chimique des composés B et C.
b) Qu'observe-t-on lorsque le test est positif avec la 2,4 - DNPH ?
2) L’analyse du composé B montre qu'il contient en masse 21,62% d’oxygène. Déterminer la
formule semi-développée et le nom des composes C, B et A.
3) Ecrire l'équation-bilan de la réaction de B avec le permanganate de potassium en milieu acide
donnant C. On donne le couple
4) On fait réagir le composé B avec un acide carboxylique CnH2n+1COOH. On obtient le composé
E qui contient en masse 64,61% de carbone.
a) Donner le nom et les caractéristiques de cette réaction.

b) Comment peut-on accélérer cette réaction?
c) Déterminer la formule semi-développée et le nom de E.
d) Donner la formule semi-développée et le nom de l‘acide carboxylique.
Physique
Exercice 1 :
Un solide de masse m=150g est accroché à l’une des extrémités d’un ressort à spires non jointives
de masse négligeable et de raideur k. L’autre extrémité du ressort étant fixé à un support, le solide
est guidé rectilignement sur un support horizontal. Les frottements sont négligeables. On
comprime le ressort d’une longueur a = 10cm par rapport à sa position d’équilibre O puis on
l’abandonne sans vitesse initiale. L’origine des dates est l’instant où on a abandonné le système
et l’origine des espaces est la position d’équilibre du ressort.
1) Montrer que le mouvement du système est rectiligne sinusoïdal.
2) A l’aide d’un chronomètre on a mesuré la durée de 20 aller-retour et on a trouvé 8,16s.
a) Déterminer la période et la pulsation du mouvement.
b) En déduire la constante de raideur du ressort.
3) Etablir l’équation horaire du mouvement sous la forme
)(
wtSinxx m
.
4) Déterminer la date du 3ème passage à la position x = 5cm.
Exercice 2 :
On dispose des trois dipôles suivants : un conducteur ohmique de résistance R, une bobine
d’inductance L et de résistance négligeable et un condensateur de capacité C. On réalise l’un des
trois montages suivants :
-D’une pile branchée aux bornes A et B : aucun courant permanent ne circule.
-D’un générateur délivrant une tension alternative sinusoïdale u=15
)100(2 utCos
branché aux
bornes A et B on note un courant d’intensité efficace I=1,5A et une puissance moyenne de 13,5W.
1) Des trois montages envisagés quel est celui qui a été étudié ? Justifier votre réponse.
2) Déterminer les caractéristiques des composants utilisés ; calculer le déphasage courant
tension on précisera laquelle des deux grandeurs est en avance sur l’autre.
3) Les trois dipôles sont montés en série, on constate alors que la tension et le courant sont en
phase.
montage1
montage2
montage3
A
B
A
B
A
B

a) Quel est le phénomène observé ?
b) Déduire des résultats numériques précédents la grandeur caractéristique du troisième
dipôle.
Exercice 3
A) Selon Bethe et Critchfield (1938), l‘une des hypothèses possible pour expliquer l'origine de
l'énergie solaire est d'envisager la succession suivante de réactions nucléaires :
;
1) Quelles sont les lois utilisées pour équilibrer l’équation d’une réaction nucléaire ?
Equilibrer les cinq réactions nucléaires précédentes, Donner les nucléides x, y, z, w sous la
formule
.
2) Par quelle réaction globale peut-on remplacer I ‘ensemble des cinq réactions ? Nommer et
définir ce type de réaction.
3) On s’intéresse maintenant au nucléide He résultant des réactions nucléaires précédentes,
a) Calculer son défaut de masse.
b) En déduire l’énergie de liaison par nucléon de ce noyau en MeV/nucléon.
On donne :
Extrait du tableau de classification périodique des éléments
Equivalences: 1u = 931,5 MeV/C2 (u : unité de masse atomique) ;
Célérité de la lumière dans le vide : C= 3.108 ms-1 ;Masse du proton: mp = 1,00728 u ;
Masse du neutron: mn = 1,00866 u; Masse de l’électron : me = 5,5. 10-4 u ;Masse du noyau d'hélium
: m
) = 4,00150 u
B) Soit la réaction nucléaire spontanée :
De demi-vie T = 7 minutes.
1) Déterminer X et Y en justifiant le calcul.
2) Calculer la constante radioactive de la réaction nucléaire,
3) Si a l’instant initial il y a No = 8.106 noyaux de
s au bout de quel temps t en restera-t-il
N0 / 100 ?

1
/
4
100%