Règles de remplissage des orbitales atomiques: Présentation Chimie
Telechargé par
soutou05

1/10
Règles de
remplissage

2/10
Plan
ÀRègles de remplissage
ÁExemples
ÂExceptions
ÃConguration électronique des ions
3/10
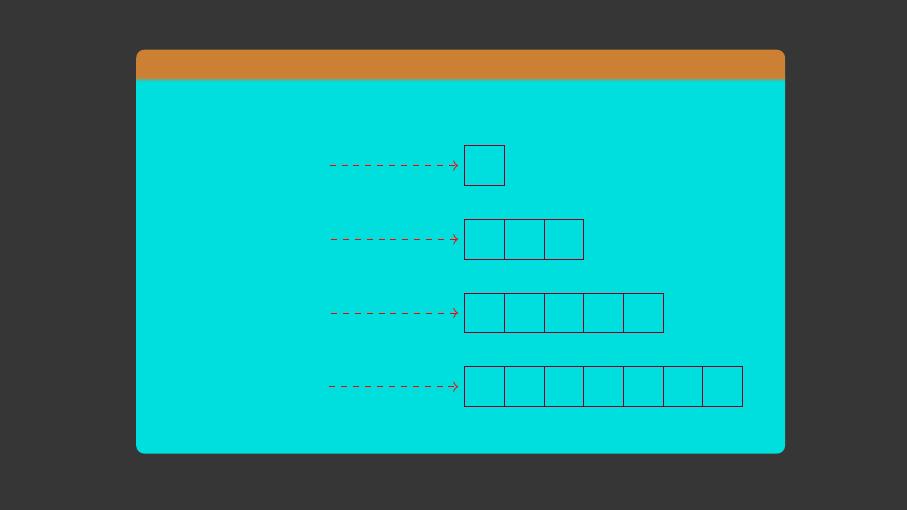
Préambule :
Notons bien qu’on va adopter dans la suite, qu’une A.O. est
représentée conventionnellement par une case quantique.
ns
ns
np
np
nd
nd
nf
nf

4/10
ÀRègles de remplissage
Pour que l’atome soit stable, les électrons doivent se répartir au sein
des O.A. (1s, 2s, 2p, ...) en respectant les règles suivantes :
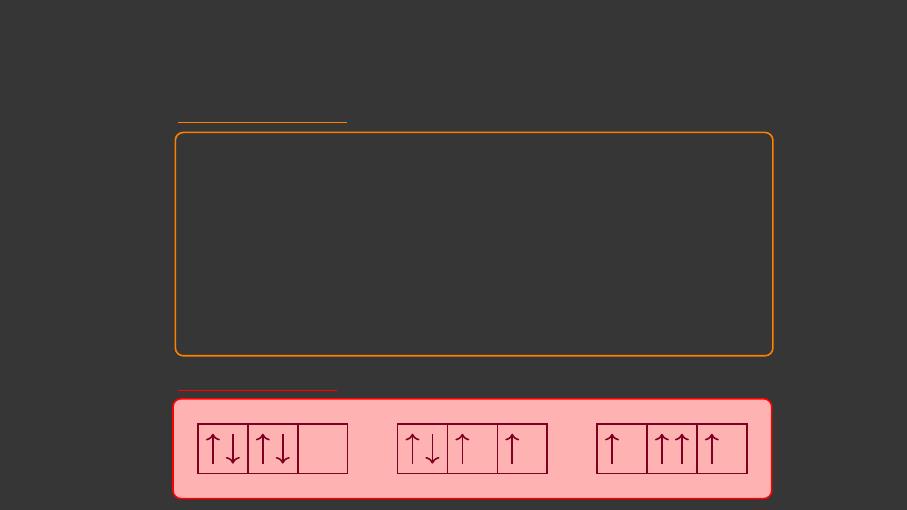
@Règle de Klechkowski
À l’état fondamental, on occupe les sous couches (s, p, d, ...)
par ordre croissant de (n+l), si deux sous couches ont la même
valeur de (n+l), on commence par celle qui a nle plus petit.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p ...
n+l123 3 4 4 5556 6 ...
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d 6f
7s 7p 7d 7f
Un jeu pour mémoriser cette règle
5/10
@Principe d’exlusion de Pauli
Deux électrons d’un même atome, ne peuvent jamais avoir quatre
nombres quantiques identiques, ils diérent au moins par ms.
:Une case quantique contient au maximum 2 électrons.
:L’O.A. ns peut être remplie par 2électrons au maximum.
L’O.A. np peut être remplie par 6électrons au maximum.
L’O.A. nd peut être remplie par 10 électrons au maximum.
L’O.A. nf peut être remplie par 14 électrons au maximum.
:Pour un niveau n,ilya2n2états électroniques possibles.
Conséquences :
Problématique
???
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%









