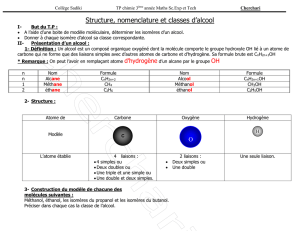
1e STLA – Devoir sur table n°2
Restitution de connaissances
1. Qu'appelle-t-on un électron de valence ?
2. Rappeler l'ordre de remplissage des 3 premières couches et sous-couches
électroniques.
3. Donner la structure électronique de l'élément Mg de numéro atomique 12
4. Un atome est désigné par le codage AX3E
a. Combien possède-t-il de doublets liants ?
b. Combien possède-t-il de doublets non-liants ?
c. Quelle est la géométrie autour de cet atome ?
5. A quelle condition une liaison covalente sera-t-elle polarisée ?
Exercice I: Le méthanol est un alcool de formule CH3OH et de densité d = 0,792.
1. Calculer sa masse molaire.
2. Déterminer ensuite la quantité de matière contenue dans 25mL d'éthanol à 95%
3. Écrire la formule de Lewis du méthanol.
4. Indiquer les charges partielles sur les atomes concernés.
5. Donner le code VSEPR pour l'atome C, puis la géométrie autour de cet atome.
6. Donner le code VSEPR pour l'atome O, puis la géométrie autour de cet atome.
7. Cette molécule est-elle polaire ? Justifier.
8. Est-elle miscible à l'eau ? Justifier.
9. Dessiner les deux types de liaison hydrogène possible entre une molécule de méthanol
et une molécule d'eau.
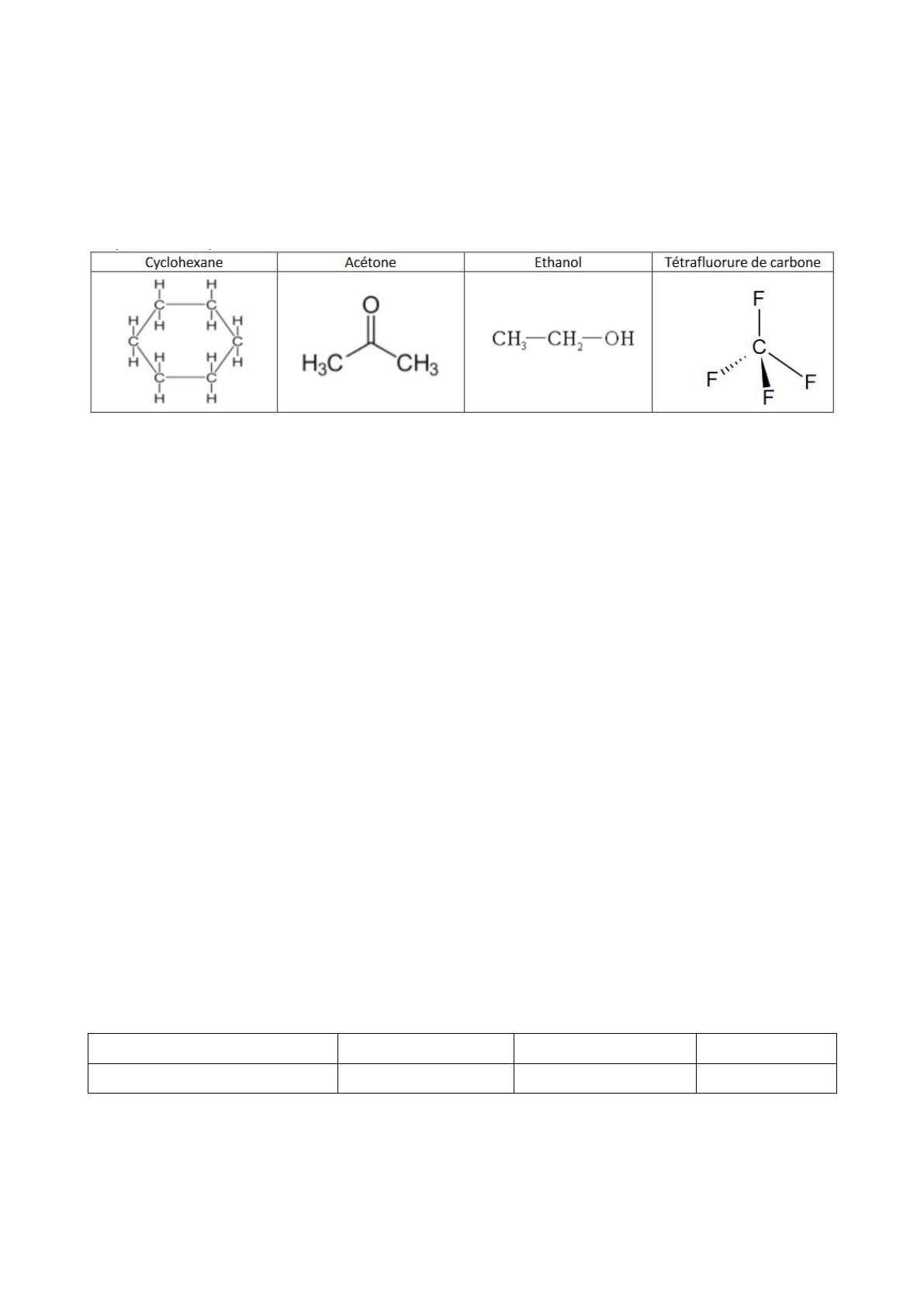
Exercice II:
Voici quelques espèces chimiques, pouvant toutes servir de solvant car liquides dans les
conditions usuelles de température et de pression.
En vous appuyant sur l’échelle d’électronégativité des éléments,
H : 2,1 C!: 2,3 F!: 4,0 O!: 3,5
1. Indiquer si les solvants cyclohexane, acétone, éthanol et tétrafluorure de carbone
possèdent des liaisons polarisées et si oui lesquelles.
2. Sur les formules des molécules (qui tiennent compte de leur géométrie), placer les
charges électriques partielles positives δ+ et négatives δ-.
3. Ces molécules sont-elles polaires ou apolaires. Justifier clairement.
4. Regroupez-les en 2 couples de molécules a priori miscibles. Justifier.
Exercice III:
Le propan-1-ol (CH3CH2CH2OH) est un des principes actif du Stérillium®, solution utilisée
en chirurgie pour désinfecter les mains et les avant-bras (antisepsie chirurgicale).
1.Du propane (CH3CH2CH3) ou du propan-1-ol, lequel possède la température d’ébullition
la plus basse ? Justifier votre réponse à l’aide des interactions intermoléculaires.
On a réalisé les mesures des températures d’ébullition de divers alcools. Les résultats
sont regroupés dans le tableau ci-dessous:
Nom de l'alcool éthanol propan-1-ol pentan-1-ol
Température d'ébullition (°C) 78 97 137
2. Interpréter les valeurs de température d'ébullition obtenues pour les 3 alcools du
tableau (alcools à chaîne linéaire)
1
/
2
100%