Résume PC-3AC-S1°
1.
Quelques matériaux au quotidien
Les objets sont formés à partir de matériaux
les grandes familles matériaux sont : les métaux ; le plastique ; le verre
matériaux
caractéristiques
Le verre
Transparent ; cassable ; isolant électrique ; mauvais conducteur de la chaleur
Les métaux
Opaque ; résistant au choc ;conducteur électrique et thermique
Le plastique
léger ; isolant électrique et a la chaleur
Les plastiques essentiels:
Le polyéthylène(P.E) : flotte dans l’eau douce (2 et 4)
Le polystyrène(P.S) : flotte dans l’eau salée. (6)
Le polychlorure de vinyle (P.V.C) :brule avec une flamme verte (3)
Le polyéthyléne téréphtalate (PET) : déformé dans l’eau bouillante (1)
Quelque propriétés des métaux :
Le fer(Fe) : attire par l’aimant
Le cuivre(Cu) : a une couleur rouge
L’aluminium (Al): le plus léger des métaux
2.
Les matériaux et l'électricité
L’atome est constitue de :
Noyau : porte charges électriques positives (Qn =+Ze)
Electrons : portent charges électriques négatives(Q𝒆−=-Ze)
e : charge élémentaire :e=1,6x10-19C ; Z : numéro atomique : -nombre de charges positives du noyau
-nombre des électrons de l’atome
L’atome est électriquement neutre :Q=Qn +Qe =(+Ze) + (-Ze) =0
Les ions :un ion est issu d’un atome ou d’u groupement d’atomes ayant perdu ou gagné un ou plusieurs
electrons.il existe deux sortes :
Cation :ion charge positif forme par perte d’électrons
(symbole Xn+),charge : +ne
Anion :ion charge négatif forme par gain d’électrons
(symbole Ym-),charge :-me
Un ion monoatomique est constitue d’un seul atome
Ion polyatomique est constitue de plusieurs atomes regroupes
3.
Oxydation de quelques métaux dans l'air
Le dioxygène de l’air humide (dioxygene+eau)réagit sur des métaux :cette réaction s’appelle oxydation
Sur le fer(Fe) : il se produit de la rouille qui est constitue essentiellement de l’oxyde de fer III(Fe2O3)
l’équation de la réaction : 4Fe +3O2 2Fe2O3
La rouille est poreuse et perméable a l’air ce qui provoque une corrosion profonde
Pour protéger le fer il faut isoler de l’air humide avec une matière non poreuse exemple la peinture…..
Sur l’aluminium(Al) :il se produit l’alumine ou l’ oxyde de l’aluminium (Al2O3)
l’équation de la réaction : 4Al + 3O2 2Al2O3
L’alumine n’estpas poreuse ,elle est superficielle ,elle protège l’aluminium de la corrosion.
4.
Combustion d’un matériau organique
Tout matériau organique ,lors de sa combustion produit essentiellement du dioxyde de carbone(CO2) et de l’eau(H2O).
Les molécules de matériaux organique sot constitues essentiellement d’atomes de carbone(C) et d’atomes
d’hydrogène(H)et d’autres atomes (Cl-O-N-S).
La combustion de certains matériaux organiques comme les plastiques produit d’autres gaz dangereux comme :
Le chlorure d’hydrogène HCl gaz irritant lors de la combustion du PVC
Le cyanure d’hydrogène HCN gaz toxique mortel lors de la combustion du nylon(polyamide
le dioxyde de soufre SO2 gaz irritant lors de la combustion du PS
5.
les acides et les bases
le pH est une grandeur sans unité qui permet d’évaluer l’acidité ou la basicité d’une solution.
Sa valeur est comprise entre 0 et 14.
Pour mesurer le pH d’une solution aqueuse ; on utilise le papier pH ou un pH-mètre(plus précis)
Solution acide
pH< 7
Nombre ions H+ plus qu’ions OH-
après la dilution le pH augmente et se
rapproche de7
Solution basique
pH> 7
Nombre ions OH- plus qu’ions H+
après la dilution le pH diminue et se
rapproche de7
Solution neutre
PH= 𝟕
Autant d’ions H+ que d’ions OH-
Le pH ne varie pas après une dilution
7
L’utilisation des solutions ou basiques présente un danger pour les utilisateurs et l’environnement
acide
neutre
0 basique 14

6.
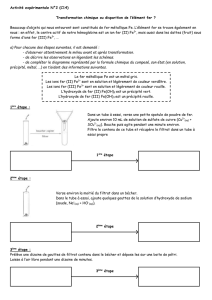
Action de l’acide chlorhydrique et de la soude sur quelques métaux
L’acide chlorhydrique (ou solution de chlorure d’hydrogène)est un acide de formule ionique (H++Cl-)
Le metal
Produit de la réaction
Equation simplifiée
Le fer(Fe)
-gaz dihydrogène(H2)(brule avec détonation)
- solution verdâtre de chlorure de fer II(Fe2++2Cl-)
Fe + 2H+ H2+ Fe2+
Le zinc(Zn)
-gaz dihydrogène(H2)(brule avec détonation)
-solution de chlorure de zinc(Zn2++ 2Cl-)
Zn+ 2H+ H2+ Zn2+
L’aluminium(Al)
-gaz dihydrogène(H2)
-solution de chlorure d’aluminium(Al3+ +3Cl-)
2AL +6H+ 3H2+ 2Al3+
Le cuivre (Cu)
Ne réagit pas avec l’acide
………………………………………………….
La soude ou solution d’hydroxyde de sodium , de formule ionique (Na+ +OH-)
La soude n’attaque pas le fer et le cuivre .
Elle réagit avec le zinc et l’aluminium ;il se produit de dihydrogène
7.
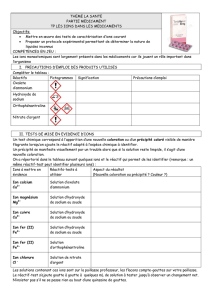
Tests de reconnaissances de certains ions
Cuivre (II) Cu2+
Hydroxyde
de sodium
(Na+ + HO-)
Bleu
Hydroxyde de
cuivre
Cu(OH)2
Cu2+ +2OH-→Cu(OH)2
Fer (II) Fe2+
Hydroxyde
de sodium
(Na+ + HO-)
vert
Hydroxyde de
fer II
Fe (OH)2
Fe2+ + 2 HO- → Fe (OH)2
Fer (III) Fe3+
Hydroxyde
de sodium
(Na+ + HO-)
Rouille
Hydroxyde
Fe3+ + 3 HO- → Fe (OH)3
de fer III
Fe (OH)3
Zinc Zn2+
Hydroxyde
de sodium
(Na+ + HO-)
Blanc
gélatineux
Hydroxyde de
zinc
Zn (OH)2
Zn2+ + 2 HO- → Zn (OH)2
Aluminium Aℓ3+
Hydroxyde
de sodium
(Na+ + HO-)
Blanc
Hydroxyde
aluminium
Aℓ (OH)3
Aℓ3+ + 3 HO- → Aℓ(OH)3
Chorure Cℓ-
Nitrate
argent
(Ag
+
+
NO
3-
)
-
Blanc qui
noircit à
la lumière
chlorure
argent
AgCℓ
Ag+ + Cℓ- → AgCℓ
8.
Danger de quelques matériaux utilisés dans la vie quotidienne sur la santé et
l’environnement
Les déchets domestiques et industriels sont constitues de différents matériaux (plastique- cartons –verres- metaux)
Les déchets polluent le sol et l’eau ;les produits de leur combustion polluent l’air
Traitement des déchets :
Recyclage des déchets : transformer les déchets collectes en matière première
Compostage des matériaux organiques naturels
Incinération pour récupérer la chaleur et produire l’électricité
1
/
2
100%