Notions Thermo :
Les 3 types de systèmes :
o Système fermé d’échange de matière avec le milieu extérieur
o Système ouvert échange d’énergie et de matière avec le milieu extérieur
o Système isolé d’échange d’énergie et de matière avec l’extérieur
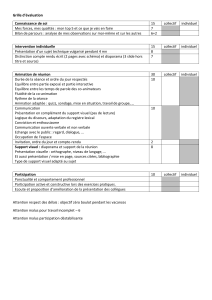
Résumé par tableau :
Echange de matière
Echange d’énergie
Système fermé
Non
Non
Système ouvert
Oui
Oui
Système isolé
Non
Oui
Les deux types de grandeurs :
o Intensives : La grandeur est indépendantes de la quantité de matière du système (exemple la
température)
o Extensives : Si la grandeur est proportionnelles à la quantité de matière du système
(exemple : le volume)
Le rapport de 2 valeurs intensives est extensif
Le modèle du gaz parfait :
Deux approximations :
o Les particules consitituant le gaz sont considérés ponctuelles
o Les interactions entre les particules ne sont pas prises en compte
Une équation d’état :
PV = nRT
Modèle de Bohr :
o Atomes consituté comme le système solaire avec les électrons en orbites
o Noyau constitué de N neutrons et de Z protons
o A = N+Z (le nombre de masse)

o Isotopes
o Les noyaux peuvent mettre des électrons en communs pour former des molécules
o Corps purs simples
o Corps purs composés
Méthode pour décrire un système :
o Décrire le système en précisant bien ses frontières
o Déterminer l’état du système défini par ses variables
Propriété d’une paroi d’un système :
o Diatherme ou diathermique : Paroi thermiquement isolé et conductrice de la chaleur
o Adiabatique : paroi n’admettant aucun transfert de chaleur
Equilibre d’un système :
o Constance de ses variables d’état au cours du temps et uniformité en tout point du système.
Deux types d’équilibres :
o Stables
o Instables
Equilibre mécanique atteint lorsque :
- Equilibre cinétique
- Equilibre gravitationnelle
- Equilibre hydrostatique
Equilibre thermodynamique :
- Equilibre thermique
- Equilibre chimique
- Equilibre électrique
Chaque équilibre à sa constante de temps.
Equation d’Etat :
Toute relation entres les variables d’état est une equation d’état.
Ex : PV = nRT est l’équation d’état des gaz parfaits

Les coefficients thermoélastiques :
- Ils traduisent des propriétés thermiques et mécaniques des fluides
- Ils peuvent s’obtenir expérimentalement
Coefficient de dilatation isobare :
Coefficient variation de pression isochore :
Coefficient de compressibilité isotherme :
Equation d’état des coefficients thermoélastique :
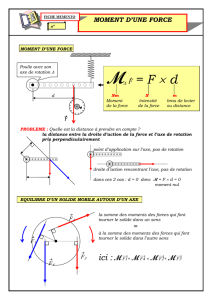
La pression :
Pour un liquide :
Donc :
Théorème d’archimède :
Pression dans un gaz :
Avec
et
(c’est la vitesse quadratique moyenne)
La température
- Elle traduit le degrés d’agitation des particules
- Elle est proportionnelle à l’énergie cinétique microscopique U
- Pour un gaz parfait contenant N particule :

Le modèle du gaz parfait :
- Le modèle du gaz réel pour les faibles pressions
A l’échelle macroscopique, il doit vérifier :
- Loi de Boyle Mariotte : T = cst alors PV = cst
- Loi de Charles gay-Lussac : la loi de variation de PV est la même pour tous les gaz
- Loi d’Avogadro-Ampère : A T fixée, PV est proportionnel à N
Equation :
Mélange de gaz parfait :
- Un mélange est dit idéal si ce mélange se comporte comme un gaz parfait
Caractéristique d’un mélange parfait :
- Fraction molaire :
- Pression partielle :
(c’est la pression qu’aurait le gaz s’il
occupait tout le volume)
- Loi de Dalton : x
1
/
4
100%