2ÈME DEVOIR DU 1ER SEMESTRE PCT 2NDE C-D 2019-2020 CEG DANTOKPA
Telechargé par
Serge Wns

DISCIPLINE - TRAVAIL – SUCCES
DEUXIEME SERIE DES EVALUATIONS SOMMATIVES DU PREMIER SEMESTRE
Epreuve : PCT Classe : 2nd CD Durée : 03 Heures
Compétence disciplinaires évaluées
CD1 : Elaborer une explication d’un fait ou d’un phénomène de son environnement naturel ou
construit en mettant les modes de raisonnement propres à la Physique, la Chimie et la
Technologie
Critère de perfectionnement : Exploiter l’information disponible et communiquer de façon
précise et appropriée.
A-CHIMIE ET TECHNOLOGIE
Contexte
L’administration de comprimés aux patients requiert une bonne maitrise de la dose en
fonction du poids de ce patient car les réactions engendrées pourraient aggraver l’état de santé du
patient. Un technicien de laboratoire se propose d’exploiter les documents suivant pour expliquer
le mécanisme de certaines réactions.
Support
Document 1
Le méthane de formule brute est un combustible constituant de gisement de gaz
naturel. Pour l’étudier, à la synthèse au laboratoire pour en recueillir de petites quantités à partir
de la réaction de décomposition de 0,240kg de carbure de d’aluminium par 500mL
d’eau.(réaction I). On obtient ainsi du méthane et on brule 2moles de ce méthane dans 100L de
dioxygène de l’air suivant une réaction de combustion dont l’équation est la réaction II. Le
volume molaire dans les conditions de l’expérience vaut
Réaction I :
Réaction II :
Document 2
A- Le trinitrate de glycéride liquide encore appelé explosif de la dynamite de formule
moléculaire très instable et sensible au moindre choc. L’équation bilan de la
décomposition de 1kg de ce liquide en vapeur d’eau et autres produits s’écrit :
Volume molaire dans les conditions de l’expérience
Masse molaire moléculaire de l’explosif : M = 227g/mol
Masse molaire en g/mol : H : 1 ; O : 16 ; C : 12 ; N : 14
B-Autres réactions
1-
2-
Document 3
Traitement de l’alcoolisme avec la molécule d’antabuse de formule brute
Un patient malade d’alcoolisme a subi un traitement d’antabuse pendant une période d’un an. IL
se rapproche de son médecin pour savoir s’il est totalement guéri ou bien s’il doit continuer le
traitement
Masse d’un comprimé d’antabuse : 400mg
Dose par jour : ¼ de comprimé
Durée maximale de traitement pour guérir de l’alcoolisme : 1an = 365jours
Z.K.M.S
CEG DE DANTOKPA Année Scolaire : 2019-2020
01 BP 1224 Tél.21 32 01 20 Premier Semestre
COTONOU
1/3
https://epreuvesetcorriges.com

Dose prise par le patient pendant les un an de traitement : 38g
Tâche : Expliquer les faits
1
1-1 Dire si chacun des mélanges des réactifs des réactions I et II est en proportion
stœchiométrique
1-2 Déterminer pour la réaction I la masse des produits formés et celle du corps resté en excès
s’il y en a :
1-3 Déterminer pour la réaction II la masse du réactif non transformé
2
2-1 Equilibrer toutes les équations du document 2
2-2 Calculer le volume total de gaz dégagé dans les conditions de l’expérience
2-3 Donner le nom de la réaction traduite par l’équation 2 du document 2
3
3-1 Donner la définition de l’atomicité d’une molécule puis donne l’atomicité de la molécule
d’antabuse et du trinitrate de glycéride
3-2 Calcule la dose en mg d’antabuse qu’un patient doit prendre par jour pour son traitement
3-3 Calculer la dose maximale en mg qu’il faut administrer à un patient en un an pour qu’il
guérisse puis joue le rôle du médecin en conseillant le patient
PHYSIQUE ET TECHNOLOGIE
Contexte
Pour renforcer les acquis de ses apprenants en seconde scientifique, un professeur de
PCT leur propose pour tâche la détermination de l’association de conducteurs ohmiques et la
détermination de quelques dipôles à partir de leurs caractéristiques. Pour ces activités, la classe
est répartie en trois groupes A, B, et C.
SUPPORT
Informations relatives au travail du groupe A :
; ;
On applique entre A et B une tension continue E = 12V
Informations relatives au travail du groupe B
Les élèves ont réalisé un circuit 1 comportant, montés en série, un générateur de f.é.m E
= 10 V et de résistance r = 4Ω avec un dipôle inconnu D1 dont l’étude a donné le tableau de
mesure suivant :
U (V)
0
1
2
3
4
5
6
I (mA)
0
10
30
70
135
235
375
Echelles :
R2
R3
R5
AB
E
R4
R6
R1
I
2/3
https://epreuvesetcorriges.com

. Ils insèrent dans le circuit 1, un dipôle inconnu D2 pour obtenir un circuit 2. L’étude du dipôle
D2 a permis de réaliser le tableau ci – dessous.
U (V)
0
0 ,2
0,4
0,6
0,8
1,0
1,2
I (mA)
0
0
0
0,5
3,5
19
39
Echelles :
Informations relatives au travail du groupe C
Pour la figure 1, un générateur de tension constante U= 18V, un conducteur ohmique de
résistance R=100Ω et une diode Zéner ayant les caractéristiques suivantes : tension de seuil Us=
0,6V et tension Zéner Uz = 8V.
Au niveau de la figure 2, on désire utiliser la diode Zéner du circuit précédent, en
stabilisateur de tension, on lui monte alors en dérivation une résistance de charge Rc et on admet
que la diode Zéner fonctionne en stabilisateur de tension si 5mAIz 80mA. La caractéristique
de cette diode, en polarisation inverse, étant assimilée à une droite d’équation Uz = 20 Iz + 8
Tâche Expliquer les faits
1
1-1 Montrer que la résistance entre les points A et B est RAB = 20 ohm.
1-2 Calculer l’intensité I du courant débité par la source E.
1-3 Déterminer les intensités des courants I1, I2,I3, I4, I5 et I6 qui traversent respectivement les
conducteurs ohmiques R1, R2,R3, R4, R5 et R6.
2
2-1 Identifier les dipôles inconnus D1 et D2 du groupe B puis faire le schéma des deux circuits
utilisés par ce groupe B.
2-2 Déterminer le point de fonctionnement du premier circuit par la méthode graphique.
2-3 Expliquer le fonctionnement du dipôle D2 puis le fonctionnement du circuit 2 du groupe B.
3
3-1 Donner la valeur de l’intensité I’ de courant qui traverserait le circuit si on inversait les
bornes de la diode Zéner au niveau du montage de la figure n°1.
3-2 Calculer la valeur de la résistance Rc du montage de la figure n°2 lorsque Iz = 10 mA.
3-3 Trouver les limites entre lesquelles, la résistance de charge Rc peut varier pour que la diode
fonctionne en stabilisateur de tension lorsque U=18V et R=100 Ω et donner les valeurs extrêmes
de la tension aux bornes de la diode Zéner.
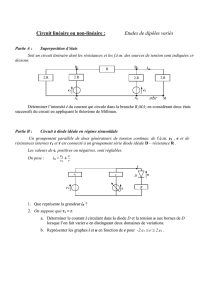
Figure n°1 Figure n°2
3/3
https://epreuvesetcorriges.com
1
/
3
100%